
����Ŀ�����������ɢϵ�������ͺ�ˮ�γɵ�����Һ���ں�����ɳ��ʳ��ˮ�������е�(I2)�ľƾ���Һ�����Ҷ����ͱ������Ļ����Һ(�Ҷ����ͱ������IJ����������ʼ��±�)��
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 | �ܽ��� |
�Ҷ��� | ��11.5 | 198 | 1.11 | ������ˮ���Ҵ� |
������ | 17.9 | 290 | 1.26 | �ܸ�ˮ���ƾ�������Ȼ��� |
������ͼ��ʾ�������������ϸ����Һ�������ͷ������ܶ�Ӧ����( )
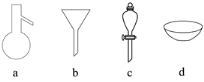
A. ���Dc�D��Һ B. ���Db�D���� C. ���Dd�D�����ᾧ D. ���Da�D����
���𰸡�C
��������
A. �����ͺ�ˮ�γɵ�����Һ���ֲ������÷�Һ���ɷ�������Ҫc��Һ©������A��ȷ��B. ������ɳ��ʳ��ˮ����ɳ������ˮ�����ù��˷���������Ҫa©������B��ȷ��C. ���е�(I2)�ľƾ���Һ�������������ƾ��ӷ������������ᾧ�ķ������ܷ��룬��C����D. �Ҷ����ͱ����������Һ����ϱ�����Ϣ��֪�����߷е����ϴ�����ѡ����������Ҫb������ƿ����D��ȷ������ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ�����������и������ʻ�Ϻ������Ժ��ֱ�����ϣ�����ȼ�պ�һ���ܵõ���ͬ���ʵ����Ķ�����̼��ˮ����( )��
A. C2H2C2H6 B. CH4C3H8 C. C3H6C3H8 D. C2H4C4H8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н���ѧ��ת��Ϊ���ܵ���
A. ȼ���� B. ��̫���ܵ�� C. ﮵�� D. ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A. 0.2 mol/L CaCl2��Һ�к��������ӵ���ĿΪ0.4NA
B. 18 g D2O������������Ϊ10NA
C. 2.24 L N2��O2�Ļ�������з�����Ϊ0.2NA
D. ��״���£�33.6 L SO3�к�����ԭ�ӵ���Ŀ����4.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֲ��ϸ���Ͷ���ϸ���д�����������Ҫ���������ǣ� ��
A. ��ά�غ���ԭ B. ��ѿ�Ǻ����� C. �����Ǻ���ά�� D. ���ۺ���ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ�� W��X��Y��Z��ԭ��������������WX2 Ϊ����ɫ���壬Y�ĵ��ʼ�����ǿ��������ǿ�Ӧ��W��Z ����������֮����X������������2 ��������˵���д������
A. Y ��X��Y��Z���γ����ӻ�����
B. ��Ӧ�����ӵİ뾶��W��X��Y
C. Z ��Ӧ����ۺ�������һԪǿ��
D. ZX2 ��һ����������ǿ�������Ҹ��Ӱ�ȫ������ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�������л����ϵͳ������ṹ��ʽ��
��1��![]() _________________
_________________
��2��CH3CH(CH3)C(CH3)2CH2CH3 ____________________________
��3��2,2-����-3-�һ����� _________________
��4��2������2����ϩ_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ԫ���� H2Y ��Һ�еμ� KOH ��Һ�����û����Һ�� pH ������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ�������й�˵���������
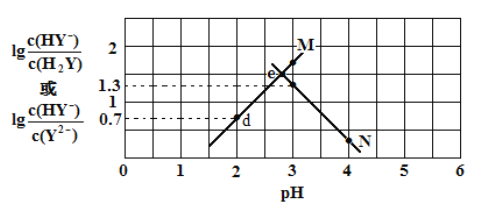
A. ���� M ��ʾ pH��![]() �ı仯��ϵ
�ı仯��ϵ
B. Ka2(H2Y)=10-2.7
C. d ����Һ��: c(H+)��c(OH -)��2c(Y2-)�� c(HY-)��c(K+)
D. ���� e ����Һ��: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ������ͼ������˵����ȷ����
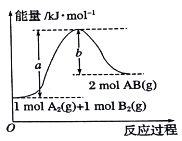
A. A2(g)+B2(g)=2AB(g)��һ�����ȷ�Ӧ
B. 2molAB������������1molA2��lmolB2������֮��
C. 1molA2(g)��1molB2(g)������֮��ΪakJ
D. 2AB(g)=A2(l)+B2(l)��H<(b-a)kJ/mo1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com