
【题目】短周期主族元素 W、X、Y、Z的原子序数依次增大,WX2 为红棕色气体,Y的单质既能与强酸又能与强碱反应,W、Z 最外层电子数之和是X最外层电子数的2 倍。下列说法中错误的是
A. Y 与X、Y与Z均形成离子化合物
B. 对应简单离子的半径:W>X>Y
C. Z 对应的最高价含氧酸是一元强酸
D. ZX2 是一种消毒能力强于氯气且更加安全的自来水消毒剂
【答案】A
【解析】短周期主族元素 W、X、Y、Z的原子序数依次增大,WX2 为红棕色气体NO2,则W为氮元素、X为氧元素;Y的单质既能与强酸又能与强碱反应,则Y为铝元素,W、Z 最外层电子数之和是X最外层电子数的2 倍,则Z的最外层电子 数为![]() ,且Z的原子序数大于铝,则Z为氯元素。A. Y 与X形成氧化铝属于离子化合物,Y与Z形成氯化铝属于共价化合物,选项A错误;B. 具有相同电子层结构的离子核电荷数越大半径越小,故对应简单离子的半径:N3->O2->Al3+,选项B正确;C. Z 对应的最高价含氧酸HClO4是一元强酸,选项C正确;D. ZX2 为二氧化氯,是一种消毒能力强于氯气且更加安全的自来水消毒剂,选项D正确。答案选A。
,且Z的原子序数大于铝,则Z为氯元素。A. Y 与X形成氧化铝属于离子化合物,Y与Z形成氯化铝属于共价化合物,选项A错误;B. 具有相同电子层结构的离子核电荷数越大半径越小,故对应简单离子的半径:N3->O2->Al3+,选项B正确;C. Z 对应的最高价含氧酸HClO4是一元强酸,选项C正确;D. ZX2 为二氧化氯,是一种消毒能力强于氯气且更加安全的自来水消毒剂,选项D正确。答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)0.3 mol NH3分子中所含原子数_____ ,质量是____,标准状况下的体积是____。
(2)含有0.4 mol Al3+的Al2(SO4)3溶液中所含SO42-的物质的量是______。
(3)等质量的SO2和SO3中, 硫原子个数之比为____,氧原子个数之比_______。
(4)配制100 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O质量为__________ ;0.5L0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是该有机物的质谱图,则其相对分子质量为________。
(2)分子式为C3H6O2的有机物,如果在核磁共振氢谱图上观察到氢的原子给出的峰有两种情况:第一种情况峰的强度比为1∶1,请写出其对应化合物的结构简式_____;第二种情况峰的强度比为3∶2∶1,请写出该化合物可能的结构简式__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法 反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度部分图象如图:
S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度部分图象如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法 ①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是___(填序号)。
a.c(Na+)+c(H+)>c(![]() )+c(
)+c(![]() )+c(OH)
)+c(OH)
b.水电离出c(H+)=1×108 mol/L
c.c(Na+)>c(![]() )>c(H+)>c(
)>c(H+)>c(![]() )
)
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加____mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的乳浊液;②含有泥沙的食盐水;③溶有碘(I2)的酒精溶液;④乙二醇和丙三醇的混合溶液(乙二醇和丙三醇的部分物理性质见下表)。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )
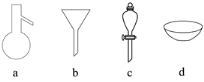
A. ①―c―分液 B. ②―b―过滤 C. ③―d―蒸发结晶 D. ④―a―蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为_______________。若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则此烃属于________烃,结构简式为______________,名称是_____________________。
若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2—二甲基丁烷,则此烃属于________烃,结构简式为_______________,名称是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.伴随能量变化的物质变化也一定是化学变化
B.有化学键变化的一定发生了化学反应
C.化学键断裂时放出能量
D.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式________,已知该反应在较低温条件下能自发进行,则该反应的△H ____0(填“>”“<”或“=”)。
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是________。
a. CO 的质量不再变化 b. 混合气体的密度不再变化
c.单位时间内生成 CO 和 NO 的物质的量相等 d. CO 和 CH3ONO 的浓度比不再变化
②10min 内该反应的速率 ν(NO)=____________;该温度下化学平衡常数 K=_________。若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________(填字母)。
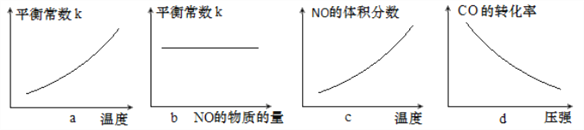
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com