
����Ŀ��̽��Na2S2O3+H2SO4=Na2SO4+SO2��+S��+H2O ��Ӧ������Ӱ�����أ����������ʵ�飬����˵����ȷ����
��ƿ | 0.1molLNa2S2O3 ��Һ/mL | ����ˮ | 0.2mol/L H2SO4 ��Һ | ��Ӧ�¶� | ���dz���ʱ��/s | ��ע |
1 | 10 | 0 | 10 | 20�� | 10 | |
2 | 10 | 5 | 5 | 20�� | 16 | |
3 | 10 | 0 | 10 | 50�� | 5 | ��10 �뿪ʼ���Dz������� |
4 | 10 | 6 | 4 | 50�� | 8 |
A. �÷�ӦҲ��ͨ����SO2������仯����ʾ��ѧ��Ӧ���ʵĿ���
B. 3��ƿ��Na2S2O3 ����ʾ����Ϊ0��0lmol/(Ls)
C. ��2��ƿ��3��ƿʵ�����ɵ��¶�Խ�߷�Ӧ����Խ��
D. ��1��ƿ��4��ƿʵ�����ɵ��¶�Խ�߷�Ӧ����Խ��
���𰸡�D
��������A��������¶ȵ�Ӱ��ϴ���˲���ͨ��SO2������ı仯����ʾ��ѧ��Ӧ���ʵĿ�������A����B��3��ƿ��10s��ʼ���Dz������࣬˵��ʵ����ȫ��v(Na2S2O3)=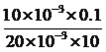 mol/(L��s)=0.005mol/(L��s)����B����C��2�ź�3�ŶԱȣ�3�������Ũ���Լ��¶ȱ�2�Ŷ࣬����˵���ĸ�Ӱ�컯ѧ��Ӧ���ʣ���C����D��1�ź�4�ŶԱȣ�1�������Ũ�ȸ���4�ţ�1�ŵ��¶ȵ���4�ŵ��¶ȣ���4�ŵķ�Ӧ���ʸ���1�ţ����˵���¶�Խ�ߣ���Ӧ����Խ�죬��D��ȷ��
mol/(L��s)=0.005mol/(L��s)����B����C��2�ź�3�ŶԱȣ�3�������Ũ���Լ��¶ȱ�2�Ŷ࣬����˵���ĸ�Ӱ�컯ѧ��Ӧ���ʣ���C����D��1�ź�4�ŶԱȣ�1�������Ũ�ȸ���4�ţ�1�ŵ��¶ȵ���4�ŵ��¶ȣ���4�ŵķ�Ӧ���ʸ���1�ţ����˵���¶�Խ�ߣ���Ӧ����Խ�죬��D��ȷ��


 ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д� ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ijЩ���ۼ��ļ������±���ʾ�����ȼ���£�N2H4����ȼ�յ��Ȼ�ѧ����ʽ�ǣ�N2H4��g��+O2��g��=N2��g��+2H2O��g����H=��5 akJmol��1��O��H�ļ���Ϊ�� ��
���۽� | N��N | N��H | O=O | N��N |
����kJmol��1 | 3a | 2.5a | 4a | 8a |
A.2a kJmol��1
B.2.5a kJmol��1
C.3a kJmol��1
D.3.5a kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵ���ƽ�ⳣ��(��Ka��ʾ)�Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
��ѧʽ | HF | H2CO3 | HClO | H2SO3 |
����ƽ�ⳣ��(Ka) | Ka=7.2��10-4 | Ka1=4.2��10-7 Ka2=5.6��10-11 | Ka=3.0��10-8 | Ka1=1.0��10-2 Ka2=5.0��10-8 |
��1��25��ʱ��ͬŨ�ȵ�HF��H2CO3��HClO������Һ�У�pH������____________(д��ѧʽ)��
��2����0.1mol��L-1��HF��Һ1mL��ˮϡ����10mL(�����¶Ȳ���)�����и����������___________(��д��ĸ)��
A��c(H+) B��c(H+)��c(OH-) C��c(H+)/c(HF) D��c(OH-)/c(H+)
��3��25��ʱ���������ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1������������Һ��
��Na2CO3��Һ ��NaHCO3��Һ ��NaF��Һ ��NaClO��Һ��
���������ж���pH�ɴ�С��˳����_________________________(��д���)��
��4������H2SO3�ĵ���ƽ�ⳣ��,����25��ʱ,0.05mol��L-1Na2SO3��Һ��pH=__________��
��ijNa2SO3��NaHSO3�Ļ��Һ�����ԣ�����Һ��c(SO32-)__________c(HSO3-)(����ڡ�����С�ڡ�����")��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ԭ��Ӧ�У���Ԫ��ֻ���ֻ�ԭ�Ե��ǣ� ��
A.H2S
B.SO2
C.H2SO3
D.H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������������������Ϊ��λ��ȡ�����������ʽΪC8H10O�����в����ܽ���NaOH��Һ�ĸ������ﹲ�� �� ����
A. 1�� B. 2�� C. 3�� D. 4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������·������з�Ӧ��������������ˮ�ⷴӦ����
A��NH4++2H2O![]() NH3H2O+H3O+ B��HCO3-+H2O
NH3H2O+H3O+ B��HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C��NH3+H2O![]() NH4++OH- D��Cl2+H2O
NH4++OH- D��Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ������ɱ�����������ã�ͨ��������ͨ�����м����������� ��
A. ��ȩ B. �ƾ� C. ���� D. ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ0.3 mol��L��1 NaOH��Һ480 mL��һ��Ũ�ȵ�������Һ��������������Һ����������ش��������⣺
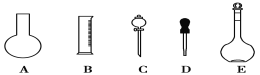
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����___(�����)������������Һ�����õ��IJ���������___(����������)��
��2��������NaOH��Һʱ��
�����ݼ�����������ƽ��ȡNaOH������Ϊ________g��
����NaOH��Һ��ת��������ƿʱ����������������������ҺŨ��________(����>������<����������)0.3 mol��L��1��
��3��ʵ���Ҳɹ���98%����=1.84gcm��3������������3.68molL��1��������Һ500mL��ȷ��ȡ98%������_____mL��
��4����ͬѧʵ������������Һ��Ũ��Ϊ3.50 mol��L��1��ԭ�������___________(�����)��
A���ý�ͷ�ιܼ�ˮʱ���ӿ̶� B������ƿ��ԭ����������ˮ
C��ϡ��������ձ�����Һת�ƺ�δϴ�� D���ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶�
��5�����ڵμ�����ˮʱ�����������˿̶��ߣ���ʱӦ��δ�����______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com