
【题目】已知某些共价键的键能如下表所示,火箭燃料肼(N2H4)的燃烧的热化学方程式是:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣5 akJmol﹣1则O﹣H的键能为( )
共价健 | N﹣N | N﹣H | O=O | N≡N |
键能kJmol﹣1 | 3a | 2.5a | 4a | 8a |
A.2a kJmol﹣1
B.2.5a kJmol﹣1
C.3a kJmol﹣1
D.3.5a kJmol﹣1
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】只给出下列甲中和乙中对应的量,不能组成一个求物质的量浓度公式的是
序号 | ① | ② | ③ | ④ | ⑤ |
甲 | 物质微粒数 | 标准状况下 气体摩尔体积 | 溶质Na2SO4的质量 | 溶质KCl的 质量分数 | 非标准状况 下物质的质量 |
乙 | 阿伏加德罗常数 | 标准状况下 气体密度 | 溶液的体积 | 溶液的密度 | 物质的摩尔质量 |
A. ①②⑤ B. ①②④⑤ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
B. 17gH2O2所含非极性键数目为0.5NA
C. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
D. 56g铁与足量氯气反应,氯气共得到3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO- + H2O + 2e- = Cl- + 2OH-,关于该电池的叙述正确的是

A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H(结构简式为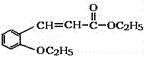 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,其合成路线如下:
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,其合成路线如下:
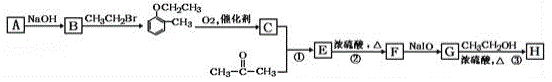
已知:①![]()
②
请回答下列问题:
(1)A的化学名称为_______________,G中所含官能团的名称是________________________;①和②的反应类型分别是______________、__________________。
(2)检验有机物A 中官能团的方法为__________________________________。
(3)高分子化合物M 的结构简式为__________________。
(4)反应③的化学反应方程式为__________________________________。
(5)有机物C 有多种同分异构体,其中属于芳香羧酸类的同分异构体有___________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境密切相关,下列有关说法错误的是:
A. CO2、NO2或SO2都会导致酸雨的形成
B. 对酸性物质的排放加以控制,开发新清洁能源是减少酸雨的有效措施
C. NO2、NO含氮氧化物是光化学烟雾的主要污染物
D. 大气中CO2含量的增加会导致温室效应加剧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米二氧化锆(ZrO2)是制备特种陶瓷(china)最重要的原料之一。由锆英石(主要成分为ZrSiO4)制备二氧化锆的工艺流程如图所示:
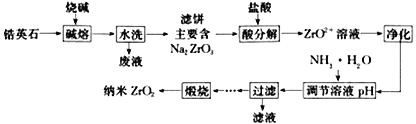
(1)写出“碱熔”时主要反应的化学方程式__________________________________。
(2)“水洗”所产生的“废液”主要成分为NaOH 和__________(填化学式),试写此成分的一种用途________________________________。
(3)写出“酸分解”生成ZrO2+反应的离子方程式__________________________________。
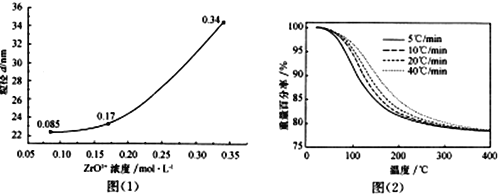
(4)根据图(1)分析ZrO2+浓度对ZrO2粒径的影响_____________________________________。
(5)ZrO2+溶液中常含有Fe3+(浓度为0.03mol·L-l),一般用草酸络合处理净化。若未净化处理直接加入氨水调节溶液pH,能否使ZrO2+完全转化为纯净的ZrO(OH)2沉淀,试通过计算说明。已知ZrO2+完全沉淀时浓度为1.0×10 -5 mol·L-l ,ZrO(OH)2、Fe(OH)3的Ksp分别为4.0×10-26、8.0×10-38, ![]() ≈3.16。__________________________________________________。
≈3.16。__________________________________________________。
(6)ZrO(OH)2煅烧制取纳米ZrO2时,升温速率与重量百分率之间的关系如图(2)所示。
煅烧时最佳升温速率为________________,理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用H2S废气制取H2的方法有利于环保。
(l) H2S的电子式是____,H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图所示,H2S的电离平衡常数ka1= ___________
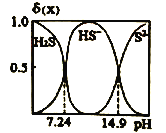
![]()
(2)利用H2S废气制取H2的方法有多种。
①热化学硫碘循环法 已知循环反应如下:
H2S(g)+ H2SO4(aq)═S(s)+ SO2(g)+2 H2O(l)△H1=61 kJ/mol
SO2(g)+I2(g)+2 H2O(l)=2HI(aq)+ H2SO4(aq)△H2=-151 kJ/mol
2HI(aq)= H2(g)+ I2(g)△H3=110kJ/mol
写出硫化氢气体分解为氢气和固体硫的热化学方程式_____。
②高温热分解法
已知:H2S (g) =H2(g)+l/2S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为cmol/L,测定H2S的转化率,H2S的平衡转化率与温度关系如图所示。据图可知:温度升高平衡常数K_______(填“增大”、“减小”或“不变”)。若985℃时平衡常数K=0.04,则起始浓度c= ______mol/L 。
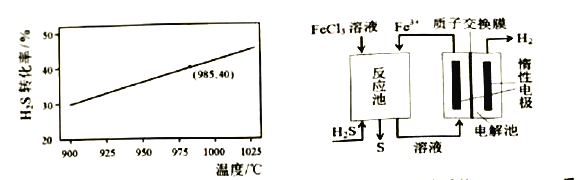
③电化学法 该法制氢过程的示意图如上图。循环利用的物质是____。反应池中化学反应方程式为______。电解池阳极电极反应式为____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com