
【题目】下列元素中,原子半径最大的是( )
A.Na
B.Mg
C.Al
D.Si
科目:高中化学 来源: 题型:
【题目】化学与环境密切相关,下列有关说法错误的是:
A. CO2、NO2或SO2都会导致酸雨的形成
B. 对酸性物质的排放加以控制,开发新清洁能源是减少酸雨的有效措施
C. NO2、NO含氮氧化物是光化学烟雾的主要污染物
D. 大气中CO2含量的增加会导致温室效应加剧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火药是中国的“四大”发明,由KNO3和两种非金属元素A和B的单质组成,A为黑色固体,B为淡黄色的固体,则下列有关说法中不正确的是( )
A.元素A与N和O同周期,B与O同主族
B.A,B分别与O组成的化合物AO和BO2均是大气的污染物
C.A和B分别与O组成的化合物均能与烧碱反应
D.单质A在一定条件下可与B的最高价氧化物的水化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
(1)写出丙元素的元素符号________,画出丙的原子结构示意图________;
(2)写出乙元素的三种核素符号分别为__________、________、________;
(3)乙、丙两种元素形成的化合物有________。(填化学式)
(4)写出甲、乙、丙三种元素组成的化合物在水中的电离方程式______________。
(5)画出甲元素的离子结构示意图______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 某原子的摩尔质量是Mgmol-1,则一个该原子的真实质量为![]() g
g
B. 氢氧化钠的摩尔质量为40g
C. 1 mol氧原子的质量就是氧的相对原子质量
D. H2SO4的摩尔质量为96g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钠溶液中得到氯化钠固体,选择装置_______ (填代表装置图的字母,下同);除去自来水中的 Cl-等杂质,选择装置________;该分离方法的名称为________.
(2)从碘水中分离出 I2,选择装置_______,该分离方法名称为_____。
(3)装置 A 中①的名称是_______ ,进水的方向是从_______ 口进水.
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用,粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是______(填选项字母)
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦c.⑤②①③④⑥⑦d.⑤③②①⑥④⑦
加入过量 Na2CO3溶液的目的是除去_____离子,如何判断离子已经沉淀完全_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.50g水中溶解12.50g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g/cm3,该溶液中CuSO4的物质的量_________,该溶液中阴阳离子的总物质的量__________,该溶液中CuSO4的物质的量浓度_________,取出20.00 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是 _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_______(填“吸热”或“放热”)反应。
②分析数据可知:现代工业生产不采用“大气固氮”原理的原因:_______。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因______________。
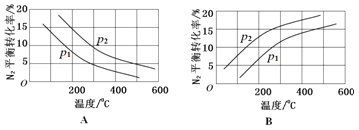
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是____(填“A”或“B”);比较P1、P2的大小关系_______。
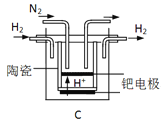
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是__________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热△H=________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H=________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1)
2H2O(l) △H=-571.6kJ·mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com