
【题目】根据如图的能量图,下列说法正确的是
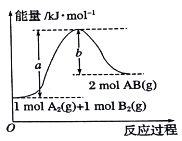
A. A2(g)+B2(g)=2AB(g)是一个放热反应
B. 2molAB的总能量大于1molA2和lmolB2的能量之和
C. 1molA2(g)和1molB2(g)的能量之和为akJ
D. 2AB(g)=A2(l)+B2(l)△H<(b-a)kJ/mo1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的乳浊液;②含有泥沙的食盐水;③溶有碘(I2)的酒精溶液;④乙二醇和丙三醇的混合溶液(乙二醇和丙三醇的部分物理性质见下表)。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )
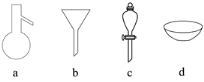
A. ①―c―分液 B. ②―b―过滤 C. ③―d―蒸发结晶 D. ④―a―蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50 mL含 Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成2.24 L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算原混合溶液中Na+的物质的量浓度?___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol / L的Na2SO3溶液30 mL,恰好将2×10-3 mol的XO4-离子还原,则元素X在还原产物中的化合价是 ( )
A.+1B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积等pH的盐酸和氯化铵两溶液,下列说法正确的是
A. 两溶液导电能力相同
B. 分别与适量且等量的锌反应,平均反应速率后者大
C. 分别与等浓度的氢氧化钠溶液反应至中性,消耗的氢氧化钠的体积相同
D. 稀释10倍后,盐酸的pH比氯化铵溶液的pH小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1和图2分别是1s电子的概率分布图和原子轨道图。下列有关认识正确的是

A. 图1中的每个小黑点表示1个电子
B. 图1中的小黑点表示某一时刻,电子在核外所处的位置
C. 图2表示1s电子只能在球体内出现
D. 图2表明1s轨道呈球形,有无数对称轴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知有机物A是一种重要的化工原料,转化关系如下图:
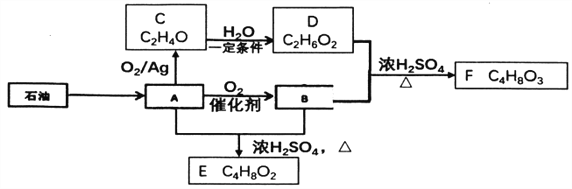
已知:同一碳原子上连接2个或2个以上-OH是不稳定结构,E能发生水解反应
请回答:
(1)A中官能团名称________。
(2)有机物C的结构简式________。
(3)B+D-F的化学方程式是________。
(4)已知![]() 能按下图方式进行裂解:
能按下图方式进行裂解:
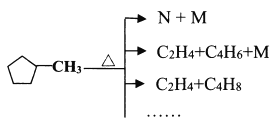
下列说法不正确的是________。
A.可用溴水区分![]() 和N
和N
B.E和![]() 都可以使酸性KMnO4褪色
都可以使酸性KMnO4褪色
C.等质量的A和![]() 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同
D.N(五元环)可能的结构有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵盐在工农业生产中有着重要的用途。回答下列问题:
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液: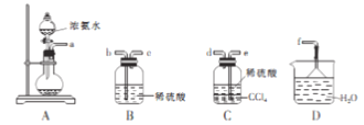
(1)用装置A制备氨气时,检验a处是否有氨气产生的方法是____________________。
(2)制取(NH4)2SO4 溶液时仪器连接的顺序(用接口字母和箭号“→”表示)是a→______________(所选装置不重复使用)。
(3)将装置C中两种液体分离,所需的主要玻璃仪器是______________________。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用用氢氧化镁热分解氯化铵制干燥氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
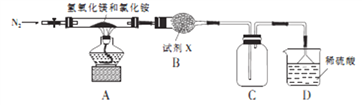
(4)氯化铵的电子式为_________________,装置A中发生反应生成碱式氯化镁的化学方程式为_____________________。
(5)装置B中试剂X为_______________________。
(6)上述装置图中有一处错误,请指出改正的方法:_______________________。
(7)MgCl2·6H2O在空气中加热,生成Mg(OH)Cl,若由MgCl2·6H2O制备无水MgCl2,实验方法为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com