
【题目】在2L恒容密闭容器中充入2molX和1molY,发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是( )
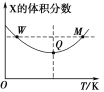
A.Q点时,Y的转化率最大
B.升高温度,平衡常数增大
C.W点X的正反应速率等于M点X的正反应速率
D.平衡时,再充入Z,达到平衡时Z的体积分数一定增大
【答案】A
【解析】
在Q对应温度之前,升高温度,X的含量减小,在Q对应温度之后,升高温度,X的含量增大,曲线上最低点为平衡点,最低点之前未达平衡,反应向正反应进行,最低点之后,各点为平衡点,升高温度X的含量增大,平衡向逆反应方向移动,故正反应为放热反应。
A.曲线上最低点Q为平衡点,升高温度平衡向逆反应移动,Y的转化率减小,所以Q点时,Y的转化率最大,故A正确;
B.已知该反应为放热反应,升高温度,平衡逆移,平衡常数减小,故B错误;
C.W点对应的温度低于M点对应的温度,温度越高,反应速率越高,所以W点X的正反应速率小于M点X的正反应速率,故C错误;
D.反应前后气体的物质的量不变,在一定温度下,平衡时充入Z,达到平衡时与原平衡是等效平衡,所以达到新平衡时Z的体积分数不变,故D错误;
故答案为A。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填在表中相应的空格内。
可供选择的试剂:A.盐酸 B.NaOH溶液 C.O2 D.水 E.不用其他试剂
可选用的操作:①水洗 ②加热 ③过滤 ④结晶
粉末状混合物 | 所选试剂 | 所选操作 | |
(1) | CaCO3(SiO2) | ______ | ______ |
(2) | NaCl(SiO2) | ______ | ______ |
(3) | SiO2(Fe2O3) | ______ | ______ |
(4) | SiO2(CaCO3) | ______ | ______ |
(5) | SiO2(Si) | ______ | ______ |
(6) | SiO2(H2SiO3) | ______ | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的装置如图所示:
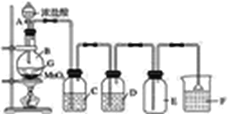
(1)实验原理:______________。
(2)实验装置:气体制备型化学实验装置的设计,要将化学反应原理、气体净化、收集和尾气处理等结合起来。
①填写装置中试剂名称,C______________,D____________,F__________。
②其中C的作用是除去氯气中的____________;D的作用是除去氯气中的____________。
③该装置中收集氯气使用的是________,还可用排__________的方法,原因是_____________。
④其中F的作用是_____________。
⑤检验氯气是否收集满可用__________放在集气瓶口,若试纸______,则证明已集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化剂存在下,在1 L的恒容密闭容器中充入0.1 molCO和0.3mol H2发生反应CO(g)+3H2(g)![]() CH4(g)+H2O(g)。反应相同时间,CO的转化率与反应温度的关系如图所示。下列说法一定正确的是
CH4(g)+H2O(g)。反应相同时间,CO的转化率与反应温度的关系如图所示。下列说法一定正确的是
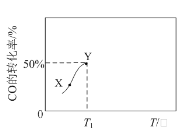
A.升高温度,CO(g)+3H2(g)![]() CH4(g)+H2O(g)的化学平衡常数增大
CH4(g)+H2O(g)的化学平衡常数增大
B.图中X点所示条件下,延长反应时间能提高CO的转化率
C.图中Y点所示条件下,改用性能更好的催化剂能提高CO的转化率
D.T1 ℃,CO(g)+3H2(g)![]() CH4(g)+H2O(g)的化学平衡常数K>1
CH4(g)+H2O(g)的化学平衡常数K>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废电路板粉碎金属料(主要含金属Cu,还含少量Zn、Fe、Pb等金属)中回收铜,其实验流程如下:
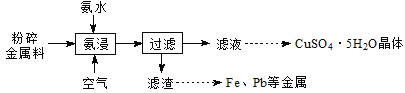
已知:一定pH范围内,Cu2+、Zn2+等能与氨形成配离子。
(1)“氨浸”在题图-1所示的装置中进行。

①鼓入空气,金属Cu可被氧化生成[Cu(NH3)4] 2+,其离子方程式为________;
②空气流量过大,会降低Cu元素的浸出率,其原因是_____________。
③“氨浸”时向氨水中加入一定量(NH4)2SO4固体,有利于Cu2+转化为[Cu(NH3)4]2+,其原因是_________。
(2)洗涤滤渣所得的滤液与“过滤”所得滤液合并的目的是________________。
(3)滤液中主要阳离子为[Cu(NH3)4]2+、NH![]() ,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq)
,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org)
Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org) ![]() CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。
CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。
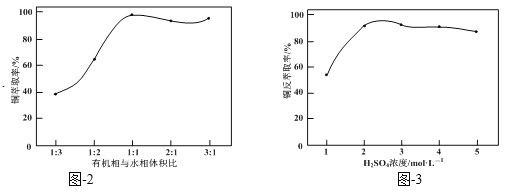
结合题图-2和题图-3,补充完整以滤液为原料,制取较纯净CuSO4·5H2O晶体的实验方案:_______,蒸发浓缩,冷却结晶,过滤洗涤干燥。(实验中可选用的试剂:有机溶剂HR、2mol·L1硫酸、3mol·L1硫酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.lmolC2H6O分子中含C-H键数目为0.5NA
B.1mol·L-1的NH4Cl溶液中含有NH4+数目小于0.1NA
C.25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.1molCl2与足量铜铁合金反应,转移电子数一定是2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(I),其合成路线如下: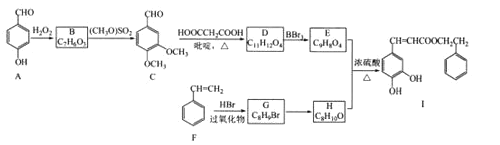
已知:①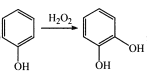 ;
;
②RCHO+HOOCCH2COOH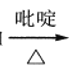 RCH=CHCOOH
RCH=CHCOOH
③当羟基与双键碳原子相连时,易发生转化:RCH=CHOH→RCHCHO
回答下列问题:
(1)化合物A的名称是____;F→G的反应类型是____。
(2)化合物B中含氧官能团的名称是___;G→H的反应所需试剂和条件分别是___、____。
(3)写出化合物I与足量NaOH溶液反应的化学方程式____。
(4)化合物W与E互为同分异构体,写出满足下列条件的W的结构简式____________。(不考虑立体异构,只需写出2个)
①化合物W与E所含官能团种类和数目完全相同,且苯环上有3个取代基;
②化合物W分子中苯环上有2种不同化学环境的氢。
(5)设计由CH3CH=CH2和HOOCCH2COOH为原料制备CH3CH2CH=CHCOOH的合成路线(无机试剂任选,合成路线常用的表示方式为:![]() )_____
)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2AB+D在四种不同条件下进行,B、D起始浓度为零,A的浓度(molL-1)随反应时间(min)的变化情况如下表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法正确的是
A.在实验1,反应在10至20分钟时间内物质A的平均速率为0.013mol/(Lmin)
B.在实验2,A的初始浓度c2>1.0molL-1
C.设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1
D.实验4中,该反应在30min后才达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com