
【题目】实验室从废电路板粉碎金属料(主要含金属Cu,还含少量Zn、Fe、Pb等金属)中回收铜,其实验流程如下:
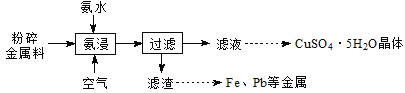
已知:一定pH范围内,Cu2+、Zn2+等能与氨形成配离子。
(1)“氨浸”在题图-1所示的装置中进行。

①鼓入空气,金属Cu可被氧化生成[Cu(NH3)4] 2+,其离子方程式为________;
②空气流量过大,会降低Cu元素的浸出率,其原因是_____________。
③“氨浸”时向氨水中加入一定量(NH4)2SO4固体,有利于Cu2+转化为[Cu(NH3)4]2+,其原因是_________。
(2)洗涤滤渣所得的滤液与“过滤”所得滤液合并的目的是________________。
(3)滤液中主要阳离子为[Cu(NH3)4]2+、NH![]() ,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq)
,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org)
Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org) ![]() CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。
CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。
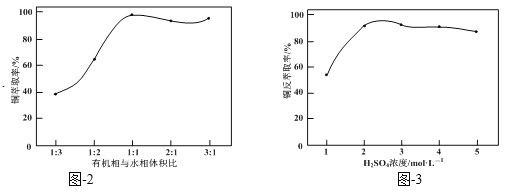
结合题图-2和题图-3,补充完整以滤液为原料,制取较纯净CuSO4·5H2O晶体的实验方案:_______,蒸发浓缩,冷却结晶,过滤洗涤干燥。(实验中可选用的试剂:有机溶剂HR、2mol·L1硫酸、3mol·L1硫酸)。
【答案】2Cu + 8NH3 ·H2O + O2 = 2[Cu(NH3)4] 2+ + 4OH-+ 6H2O 空气流量过大,氨的挥发量增多,铜的浸出率减小 增加NH![]() 的浓度,会抑制NH3 ·H2O的电离平衡,增大溶液中NH3·H2O浓度 提高铜元素的利用率
的浓度,会抑制NH3 ·H2O的电离平衡,增大溶液中NH3·H2O浓度 提高铜元素的利用率 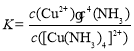 将滤液和有机溶剂HR按体积比1∶1混合,充分振荡,静置分层。分液,取有机相,加入适量2 mol·L-1硫酸,充分振荡,静置分层。分液,取水相
将滤液和有机溶剂HR按体积比1∶1混合,充分振荡,静置分层。分液,取有机相,加入适量2 mol·L-1硫酸,充分振荡,静置分层。分液,取水相
【解析】
金属料(主要含金属Cu,还含少量Zn、Fe、Pb等金属)加入氨水同时通入空气进行氨浸,Cu、Zn被氧化后和氨水形成配合物溶于水中,过滤除去Fe、Pb等金属;得到的滤液中主要阳离子为[Cu(NH3)4]2+、NH,还含有一定量的[Zn(NH3)4]2+;之后利用有机溶剂HR萃取Cu2+,萃取后再向有机相中加入稀硫酸,反萃取得到CuSO4溶液,之后经蒸发浓缩,冷却结晶,过滤洗涤干燥得到硫酸铜晶体。
(1)①鼓入空气,金属Cu可被氧化生成[Cu(NH3)4] 2+,氧化剂应为氧气,结合电子守恒和元素守恒可得离子方程式为2Cu + 8NH3 ·H2O + O2= 2[Cu(NH3)4] 2+ + 4OH-+ 6H2O;
②空气流量过大,氨的挥发量增多,导致铜的浸出率减小;
③“氨浸”时向氨水中加入一定量(NH4)2SO4固体,可增加NH![]() 的浓度,会抑制NH3 ·H2O的电离平衡,增大溶液中NH3·H2O浓度,有利于Cu2+转化为[Cu(NH3)4]2+;
的浓度,会抑制NH3 ·H2O的电离平衡,增大溶液中NH3·H2O浓度,有利于Cu2+转化为[Cu(NH3)4]2+;
(2)洗涤滤渣所得的滤液中含有铜元素,洗涤滤渣所得的滤液与“过滤”所得滤液合并可提高铜元素的利用率;
(3)铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) +4NH3(aq),其平衡常数表达式为
Cu2+(aq) +4NH3(aq),其平衡常数表达式为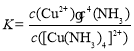 ;
;
据图可知当有机相和水相体积比为1:1时,铜的浸取率已经很高,继续增大有机相的体积浸取率有所下降,所以萃取时有机相和水相体积比取1:1;据图可知当硫酸的浓度为2mol/L和3mol/L时反萃取率相差不大,但浓度过大会造成硫酸的浪费,所以反萃取时硫酸的浓度选2mol/L,具体操作为:将滤液和有机溶剂HR按体积比1∶1混合,充分振荡,静置分层。分液,取有机相,加入适量2 mol·L-1硫酸,充分振荡,静置分层。分液,取水相,蒸发浓缩,冷却结晶,过滤洗涤干燥。


科目:高中化学 来源: 题型:
【题目】常温下一种烷烃A和一种单烯烃B组成混合气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将该混合气体1L充分燃烧在同温、同压下得2.5LCO2,试推断原混合气体A中和B所有可能的组合及其体积比___。
(2)120℃时取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定混合气中各成分的分子式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈黄绿色,证明氯水中含有的粒子是________。
(2)向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中含有的粒子是________。
(3)盛有氯水的试管中的有色布条褪色,说明氯水中含有的粒子是________。
(4)将紫色石蕊溶液滴入新制氯水中,溶液显红色。起作用的微粒是________,过一会儿,溶液的颜色褪去,起作用的微粒是________。
(5)向氯水中滴加硝酸银溶液有白色沉淀生成,证明氯水中含有的粒子是________。
(6)氯水经光照后,颜色逐渐消失,放出的气体是________,溶液的酸性________(填“增强”“不变”或“减弱”)。
(7)将氯气通入水中,所得溶液中具有氧化性的含氯微粒是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中的硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
A. 反应前2min的平均速率v(SO2)=0.1amol/(L.min)
B. 当混合气体的物质的量不再改变时,反应达到平衡状态
C. 平衡后保持其它条件不变,从容器中分离出部分硫,平衡向正反应方向移动
D. 平衡后保持其他条件不变,升高温度和加入催化剂,SO2的转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2molX和1molY,发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是( )
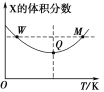
A.Q点时,Y的转化率最大
B.升高温度,平衡常数增大
C.W点X的正反应速率等于M点X的正反应速率
D.平衡时,再充入Z,达到平衡时Z的体积分数一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度,将2molCO与5 mol H2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。
CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。
(1)0~5min内,v(CH3OH)=____
(2)若保持体积不变,再充入2molCO和1.5molCH3OH,此时v(正)__v(逆)(填“>”“<”或“=”),平衡常数为____。
(3)在题干其他条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,H2的体积分数与原平衡对比:____。
(4)已知CO与H2在一定条件下也能合成乙醇,0.5mol乙醇液体燃烧生成二氧化碳和水蒸气,放出的热量为617.1kJ/mol,又知H2O(l)═H2O(g);△H=+44.2kJ/mol,请写出乙醇燃烧热的热化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中发生反应:A(g)+3B(g) ![]() 2C(g),下列有关说法正确的是
2C(g),下列有关说法正确的是
A.若加入催化剂,则反应的△H 增大
B.加压时,平衡向正反应方向移动,反应的平衡常数增大
C.若反应温度升高,则活化分子的百分数增大,反应速率增大
D.若低温时,该反应为正向自发进行,则△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com