
【题目】一定条件下,通过下列反应可实现燃煤烟气中的硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
A. 反应前2min的平均速率v(SO2)=0.1amol/(L.min)
B. 当混合气体的物质的量不再改变时,反应达到平衡状态
C. 平衡后保持其它条件不变,从容器中分离出部分硫,平衡向正反应方向移动
D. 平衡后保持其他条件不变,升高温度和加入催化剂,SO2的转化率均增大
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O![]() X+H2
X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A. G、Y、Q、Z、X B. X、Z、Q、G、Y
C. X、Z、Q、Y、G D. G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。
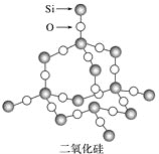
下列关于二氧化硅晶体网状结构的叙述正确的是
A. 存在四面体结构单元,O处于中心,Si处于4个顶角
B. 在最小的环上,有3个Si原子和3个O原子
C. 在最小的环上,Si和O的原子个数之比为1∶2
D. 在最小的环上,有6个Si原子和6个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的装置如图所示:
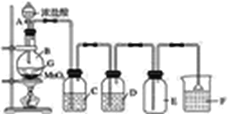
(1)实验原理:______________。
(2)实验装置:气体制备型化学实验装置的设计,要将化学反应原理、气体净化、收集和尾气处理等结合起来。
①填写装置中试剂名称,C______________,D____________,F__________。
②其中C的作用是除去氯气中的____________;D的作用是除去氯气中的____________。
③该装置中收集氯气使用的是________,还可用排__________的方法,原因是_____________。
④其中F的作用是_____________。
⑤检验氯气是否收集满可用__________放在集气瓶口,若试纸______,则证明已集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用下列装置探究氯气与氨气的反应.其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
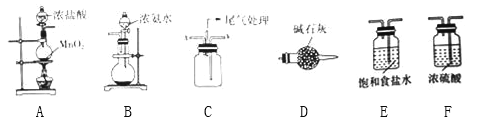
(1)若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→________________→B;为使NH3与Cl2更充分混合,Cl2应从C装置的__口进入(填“x”或“y”).
(2)简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是__________________.
(3)装置A中发生反应的离子方程式为_______________________________.
(4)装置B中圆底烧瓶内的试剂为______________(填名称).
(5)装置D的作用是____________________________.
(6)反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化剂存在下,在1 L的恒容密闭容器中充入0.1 molCO和0.3mol H2发生反应CO(g)+3H2(g)![]() CH4(g)+H2O(g)。反应相同时间,CO的转化率与反应温度的关系如图所示。下列说法一定正确的是
CH4(g)+H2O(g)。反应相同时间,CO的转化率与反应温度的关系如图所示。下列说法一定正确的是
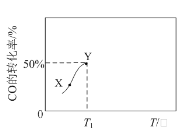
A.升高温度,CO(g)+3H2(g)![]() CH4(g)+H2O(g)的化学平衡常数增大
CH4(g)+H2O(g)的化学平衡常数增大
B.图中X点所示条件下,延长反应时间能提高CO的转化率
C.图中Y点所示条件下,改用性能更好的催化剂能提高CO的转化率
D.T1 ℃,CO(g)+3H2(g)![]() CH4(g)+H2O(g)的化学平衡常数K>1
CH4(g)+H2O(g)的化学平衡常数K>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废电路板粉碎金属料(主要含金属Cu,还含少量Zn、Fe、Pb等金属)中回收铜,其实验流程如下:
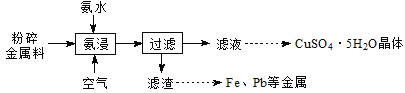
已知:一定pH范围内,Cu2+、Zn2+等能与氨形成配离子。
(1)“氨浸”在题图-1所示的装置中进行。

①鼓入空气,金属Cu可被氧化生成[Cu(NH3)4] 2+,其离子方程式为________;
②空气流量过大,会降低Cu元素的浸出率,其原因是_____________。
③“氨浸”时向氨水中加入一定量(NH4)2SO4固体,有利于Cu2+转化为[Cu(NH3)4]2+,其原因是_________。
(2)洗涤滤渣所得的滤液与“过滤”所得滤液合并的目的是________________。
(3)滤液中主要阳离子为[Cu(NH3)4]2+、NH![]() ,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq)
,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org)
Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org) ![]() CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。
CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。
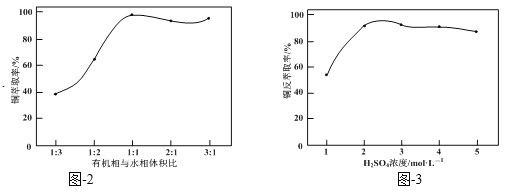
结合题图-2和题图-3,补充完整以滤液为原料,制取较纯净CuSO4·5H2O晶体的实验方案:_______,蒸发浓缩,冷却结晶,过滤洗涤干燥。(实验中可选用的试剂:有机溶剂HR、2mol·L1硫酸、3mol·L1硫酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.lmolC2H6O分子中含C-H键数目为0.5NA
B.1mol·L-1的NH4Cl溶液中含有NH4+数目小于0.1NA
C.25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.1molCl2与足量铜铁合金反应,转移电子数一定是2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.氯乙烯与丙烯的共聚物高分子中可能存在“![]() ”的连接方式
”的连接方式
B.丙氨酸和苯丙氨酸脱去一分子水,最多可生成4种二肽
C.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
D.![]() 和
和![]() 均可以通过缩聚反应制取
均可以通过缩聚反应制取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com