
【题目】NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管,足量浓H2SO4的洗气瓶,最后得到的气体是( )
A. NH3B. O2C. H2OD. CO2
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】碳、氮、锌、汞的相关化合物在化工、医药、材料方面有着广泛的应用
(1)画出基态Zn原子的价电子排布图_________;
(2)在基态N原子中,核外电子占据的最高能层符号为________,占据该能层电子的电子云轮廓图形状为____________;
(3)Zn,Cd,Hg均为第ⅡB族元素,根据相对论收缩效应致,全满的6s壳层非常稳定,已知Hg原子的核外电子排布式为[Xe]4f145d106s2,请解释Hg在常温下为液态的原因_________________________;
(4)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:________________________________;
(5)纳米氧化锌是稳定的化合物,可以提供广谱的紫外保护(UVA和UVB),同时还有抗菌和抗炎的作用,一种氧化锌晶体具有ZnS型结构,边长为 a=0.446nm,求:
①Zn和O之间最短的距离为________nm;
②与Zn紧邻的O的个数为_______.

晶胞内部原子为Zn,顶点和面心原子为O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某居民小区垃圾收集点有三个垃圾桶,分别标明“厨余垃圾”、“电池”、“可回收物”。下列物质中不应投入“可回收物”桶内的是
A. 玻璃碎片 B. 破塑料盒 C. 纸制包装盒 D. 瓜皮果壳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氨气与氯化氢反应的装置。抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )

A. 气体反应物的总体积为0.224 L
B. 生成物的分子个数为0.005NA
C. 生成物中的N—H键个数为0.02NA
D. 加水溶解后所得溶液中NH4+数目为0.005NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:O3 + 2I- + H2O = O2 + I2 + 2OH-,下列说法不正确的是
A. O3和O2是同素异形体 B. H2O既不是氧化剂也不是还原剂
C. 氧化性:I2>O2 D. 反应生成1mol I2时转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B分子数相等,下列说法不正确的是( )
A.标准状况下,同体积的气体A和气体B的质量比m:n
B.25℃,101KPa时,1Kg气体A与1Kg气体B的分子数比为n:m
C.同温同压下,气体A与气体B密度比为n:m
D.标准状况下,等质量的A与B的体积比为n:m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所示为某市新设的一组垃圾箱的文字说明。
某市生活垃圾分类种类 | ||
可回收垃圾(A) | 不可回收垃圾(B) | 有害垃圾(C) |
纸类 玻璃 金属 塑料 橡胶 纺织品 | 厨房垃圾 灰土 杂草 枯枝 花卉 | 日光灯管 电池 喷雾罐 指甲油瓶 药瓶 涂改液瓶 |
(1)烂苹果应放入____,废弃光盘应放入_____(填字母)
(2)图示“![]() ”应贴在______(填字母)
”应贴在______(填字母)
(3)为治理“白色污染”,有人提出把塑料垃圾集中,然后集中在露天焚烧,这种处理方法的弊端是______________________________(写出其中一种)
(4)下列关于垃圾处理方法正确的是(____)
A.填埋垃圾不需要技术标准,只需深埋即可
B.废旧电池无需任何处理,只需集中深埋即可
C.废旧玻璃可重新熔炼、再生,重新制玻璃仪器
D.废弃塑料、橡胶、合成纤维等可进行堆肥处理.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是盛硫酸的试剂瓶上的标签的部分内容,现实验需要0.5mol·L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室己有的仪器和药品情况回答下列问题:
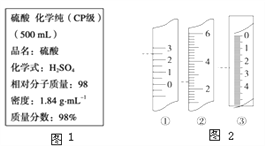
(1)容量瓶应如何检漏____________________________________。
(2)实验中除量筒、烧杯外还需要的其他仪器________________;
(3)计算所需浓硫酸的体积约为____mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数__________49%(填“<”、“=”或“>”)。
(4)下列操作会引起所配溶液浓度偏大的是_______(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,溶液未冷却
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(5)温度计、量筒、滴定管的一部分如图2所示,下述读数(虚线所指刻度)及说法正确的是_____ (填字母)。
A.①是量筒,读数为2.5mL B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.5mL D.①是温度计,读数为2.5℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种酸性较强的溶液中,可能存在NO3-、I-、Cl-和Fe3+中的一种或几种,向该溶液中加入溴水后,溴单质被还原,由此可推知这种溶液中
A. 含I-,不能确定是否含Cl-B. 含NO3-
C. 含I-、NO3-、Cl-D. 含Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com