
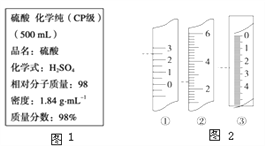
【题目】如图1是盛硫酸的试剂瓶上的标签的部分内容,现实验需要0.5mol·L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室己有的仪器和药品情况回答下列问题:
(1)容量瓶应如何检漏____________________________________。
(2)实验中除量筒、烧杯外还需要的其他仪器________________;
(3)计算所需浓硫酸的体积约为____mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数__________49%(填“<”、“=”或“>”)。
(4)下列操作会引起所配溶液浓度偏大的是_______(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,溶液未冷却
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(5)温度计、量筒、滴定管的一部分如图2所示,下述读数(虚线所指刻度)及说法正确的是_____ (填字母)。
A.①是量筒,读数为2.5mL B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.5mL D.①是温度计,读数为2.5℃
【答案】 向容量瓶中加水盖上瓶塞倒立,观察是否漏水,然后正立,旋转瓶塞180度,倒立,观察 500mL容量瓶,玻璃棒、胶头滴管 13.6 > AB BD
【解析】试题分析:(1)容量瓶检漏的方法是加适量水后塞紧瓶塞倒置不漏水,然后正放,应注意瓶塞要旋转180度,再倒置看是否漏水;(2)由于没有480mL的容量瓶,故应使用500mL的容量瓶,根据配制过程可知,还缺少500mL容量瓶、玻璃棒、胶头滴管;(3)浓硫酸的物质的量浓度为![]() =18.4mol/L;设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变:V×18.4mol/L=0.5mol/L×0.5L,解得V=0.0136L,即13.6mL;水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%(4)仰视量筒时,量筒中实际液面高于看到的液面,导致硫酸取多了,结果偏高;未冷却即转移至容量瓶,冷却后液面会低于刻度线,导致浓度偏高,C选项操作引起结果偏低;选项D.定容后倒置摇匀后再正立时,发现液面低于刻度线,由于容量瓶刻度线上方有部分残留溶液,该选项属于正常现象,不影响配制结果,故答案为AB;(5)A.量筒上没有0刻度值,故A错误;B.量筒的读数能够读到0.1mL,图②中液体体积为2.5mL,故B正确;C.滴定管读数时应保留两位小数,正确读数为2.50mL,故C错误;D.只有温度计的0刻度下还有数据,且图示温度为2.5℃,故D正确;故答案为BD。
=18.4mol/L;设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变:V×18.4mol/L=0.5mol/L×0.5L,解得V=0.0136L,即13.6mL;水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%(4)仰视量筒时,量筒中实际液面高于看到的液面,导致硫酸取多了,结果偏高;未冷却即转移至容量瓶,冷却后液面会低于刻度线,导致浓度偏高,C选项操作引起结果偏低;选项D.定容后倒置摇匀后再正立时,发现液面低于刻度线,由于容量瓶刻度线上方有部分残留溶液,该选项属于正常现象,不影响配制结果,故答案为AB;(5)A.量筒上没有0刻度值,故A错误;B.量筒的读数能够读到0.1mL,图②中液体体积为2.5mL,故B正确;C.滴定管读数时应保留两位小数,正确读数为2.50mL,故C错误;D.只有温度计的0刻度下还有数据,且图示温度为2.5℃,故D正确;故答案为BD。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是

A. 铜棒为正极,其电极反应式为2H++2e- = H2↑
B. 烧杯左侧碳棒为阴极,其电极表面有红色物质析出
C. 反应中消耗锌的质量为13 g
D. 导线中通过的电子的物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管,足量浓H2SO4的洗气瓶,最后得到的气体是( )
A. NH3B. O2C. H2OD. CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3 , 溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w= ![]() ×100%
×100%
②c= ![]()
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w.
A.①③
B.②③
C.①②
D.只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在0.1 mol/L的醋酸中,水溶液的KW值为( )
A. 大于1×10-14 B. 小于1×10-14 C. 等于1×10-14 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件的改变可使活化分子百分数增加的是( )
①增加反应物浓度 ②增大气体的压强 ③升高体系的温度 ④使用催化剂
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学提倡化工生产应提高原子利用率.原子利用率表示目标产物的质量与生成物总质量之比.在下列氮肥的制备反应中,原子利用率最高的是( )
A.NH3+H2O+CO2=NH4HCO3
B.2NH3+CO2 ![]() ?CO(NH2)2+H2O
?CO(NH2)2+H2O
C.8NH3+3Cl2═N2+6NH4Cl
D.2NH3+2O2 ![]() NH4NO3+H2O
NH4NO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成mmolA同时消耗qmol的D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率vA:vB:vC:vD=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化,其中一定能说明反应已达到平衡状态的是
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成mmolA同时消耗qmol的D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率vA:vB:vC:vD=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化,其中一定能说明反应已达到平衡状态的是
A. ②③④⑥ B. ③⑥⑦ C. ②③⑥ D. ③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com