
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
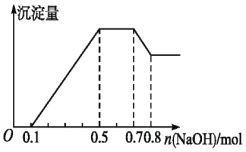
、![]() 中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是![]()
A.溶液中的阳离子有![]() 、
、![]() 、
、![]() 、
、![]()
B.溶液中![]() mol
mol
C.溶液中一定不含![]() ,可能含有
,可能含有![]()
D.![]() :
:![]() :
:![]() :2:1
:2:1
【答案】C
【解析】
若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则![]() 不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在
不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在![]() ;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有
;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有![]() 、
、![]() ;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在
;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在![]() ,由于溶液中还必须存在阴离子,所以一定还有
,由于溶液中还必须存在阴离子,所以一定还有![]() ;由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为
;由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为![]() ,则
,则![]() ;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为
;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为![]() ,则
,则![]() ;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠
;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠![]() ,则
,则![]() ,根据铝元素守恒可知
,根据铝元素守恒可知![]() ;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为
;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为![]() ,则
,则![]() 。
。
A. 据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,所以溶液中的阳离子一定含![]() 、
、![]() 、
、![]() 、
、![]() ,故A正确;
,故A正确;
B. 最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠![]() ,则
,则![]() ,根据铝元素守恒可知
,根据铝元素守恒可知![]() ,故B正确;
,故B正确;
C. 由以上分析得溶液中一定不含![]() ,一定含有
,一定含有![]() ,故C错误;
,故C错误;
D. 根据第一段是氢氧化钠中和氢离子的阶段,所以氢离子的物质的量是![]() ,根据第四段是氢氧化铝和氢氧化钠反应的阶段,即
,根据第四段是氢氧化铝和氢氧化钠反应的阶段,即![]() ,则消耗氢氧化钠的物质的量为:
,则消耗氢氧化钠的物质的量为:![]() ,根据第二段是将铝离子和镁离子反应生成沉淀的阶段,根据
,根据第二段是将铝离子和镁离子反应生成沉淀的阶段,根据![]() ,
,![]() ,
,![]() 氢氧化铝消耗氢氧化钠的物质的量是
氢氧化铝消耗氢氧化钠的物质的量是![]() ,所以镁离子消耗氢氧化钠的物质的量是:
,所以镁离子消耗氢氧化钠的物质的量是:![]() ,所以镁离子的物质的量是
,所以镁离子的物质的量是![]() ,即
,即![]() :
:![]() :
:![]() :
:![]() :
:![]() :2:1,故D正确。
:2:1,故D正确。
故答案选C。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
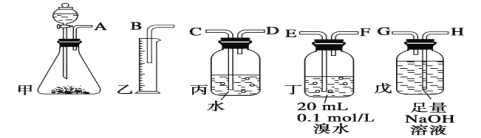
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是_______(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项)。
A.
B.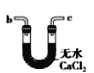
C.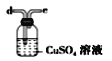
D.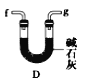
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表达正确的是( )
A. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
B. 邻硝基甲苯的结构简式为![]() ,能发生取代反应
,能发生取代反应
C. 钾长石(KAlSi3O8)写成氧化物形式为:K2OAl2O36SiO2
D. 反应的电子转移情况: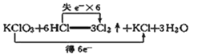
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,氧元素的质量分数为31.58%。A遇FeCl3溶液显紫色,A能与NaHCO3溶液反应,其苯环上的一氯取代物有两种,请回答下列问题:
(1)A的分子式是_______________________________。
(2)A的结构简式为________________________________________。
(3)A可以发生如图所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式________。

(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点290 ℃,熔点18.17 ℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度。甲、乙两装置相比较,乙装置有哪些优点________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行了如图所示的实验,由实验现象得到的结论中正确的是
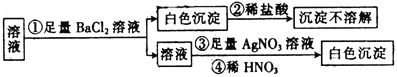
A.原溶液中一定只含有SO![]()
B.原溶液中一定含有SO![]() 和Cl-
和Cl-
C.原溶液中一定只含有Cl-
D.原溶液中可能含有SO![]() ,也可能含有Cl-
,也可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.室温下,向NH4HSO4溶液中加入NaOH溶液至中性,则c(![]() )>c(Na+)>c(
)>c(Na+)>c(![]() )
)
B.体积相等pH=12的氨水和NaOH溶液中和盐酸的能力相同
C.向10ml 0.01mol/L AgNO3溶液中依次滴入2~3滴0.01mol/L NaCl溶液、0.01mol/L NaI溶液,所得沉淀由白色变成黄色,则可推知Ksp(AgI)<Ksp(AgCl)
D.物质的量浓度之比为1:2的CH3COOH和CH3COONa的混合溶液中: 2[c(CH3COOH)+c(CH3COO-)]=3c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。
(1)工业上处理100L Cr2O72-含量为108mgL-1的含铬废水,至少需要______L(标准状况) SO2。
(2)已知:Ksp[Cr(OH)3]=1×10-30,室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6molL-1),需调节溶液pH______。
(3)三价铬Cr(III)与双氧水反应可用于合成铬黄(PbCrO4),控制其他条件不变,调节反应温度,考察反应温度对Cr(III)转化率的影响(如图所示),温度超过70℃时,Cr(III)转化率下降的原因是______。
(4)光照下,草酸(H2C2O4)也能将Cr2O72-转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份,其中一份与酸性KMnO4溶液充分反应(反应后MnO4-被还原成Mn2+),消耗浓度为0.4000molL-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述②溶液中再滴加![]() 溶液,产生白色沉淀;④
溶液,产生白色沉淀;④![]() 取③中上层清液继续滴加
取③中上层清液继续滴加![]() 溶液至无沉淀时,再滴加
溶液至无沉淀时,再滴加![]() 溶液,产生白色沉淀。根据实验以下推测正确的是
溶液,产生白色沉淀。根据实验以下推测正确的是
A.一定有![]() 离子B.不一定有
离子B.不一定有![]() 离子
离子
C.不能确定![]() 离子是否存在D.不能确定
离子是否存在D.不能确定![]() 离子是否存在
离子是否存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com