
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
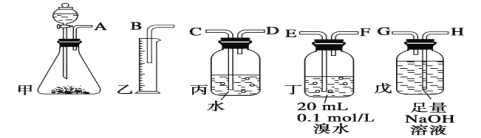
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是_______(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项)。
A.
B.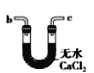
C.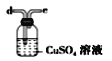
D.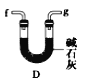
【答案】CaC2+2H2O→C2H2↑+Ca(OH)2 AHGEFDCB 饱和食盐水  ×100% 偏高 H2S+Br2=S↓+2HBr BD
×100% 偏高 H2S+Br2=S↓+2HBr BD
【解析】
(1)电石的主要成分是CaC2,与水反应可制取乙炔;
(2)电石与足量的水反应生成乙炔,制取的乙炔中含有H2S,用氢氧化钠溶液吸收,乙炔被溴水吸收后剩余的部分通过排水法测量其体积;
(3)实验室一般用饱和食盐水代替水进行试验,以获得平稳的气流;
(4)根据溴单质的物质的量求出消耗的乙炔的物质的量,再根据水的体积求出乙炔的体积,根据乙炔的物质的量求出CaC2的质量,进一步计算纯度;
(5)H2S具有还原性,能够与Br2发生氧化还原反应,导致测得的乙炔的物质的量偏大;
(6)干燥乙炔,所选择的物质应具有吸水性;
(1)电石的主要成分是CaC2,与水反应可制取乙炔,反应方程式为:CaC2+2H2O→C2H2↑+Ca(OH)2;
(2)电石与足量的水反应生成乙炔,制取的乙炔中含有H2S,用氢氧化钠溶液吸收,乙炔被溴水吸收后剩余的部分通过排水法测量其体积,因此仪器的连接顺序为AHGEFDCB;
(3)实验室一般用饱和食盐水代替水进行试验,以获得平稳的气流;
(4)标准状况下溴水与乙炔完全反应生成C2H2Br4,溴单质的物质的量为0.1mol/L×0.02L=0.002mol,消耗乙炔为0.001mol,测得量筒内液体体积V mL,则乙炔的体积为V mL,物质的量为![]() =
=![]() mol,因此乙炔总的物质的量为0.001mol+
mol,因此乙炔总的物质的量为0.001mol+![]() mol,根据反应CaC2+2H2O→C2H2↑+Ca(OH)2可知CaC2得物质的量为0.001mol+
mol,根据反应CaC2+2H2O→C2H2↑+Ca(OH)2可知CaC2得物质的量为0.001mol+![]() mol,质量为(0.001mol+
mol,质量为(0.001mol+![]() mol)×64g/mol,因此电石的纯度为
mol)×64g/mol,因此电石的纯度为 ×100%;
×100%;
(5)H2S具有还原性,能够与Br2发生氧化还原反应,导致测得的乙炔的物质的量偏大,最终测得电石的纯度偏高,发生的反应为:H2S+Br2=S↓+2HBr;
(6)干燥乙炔,所选择的物质应具有吸水性,可选用无水氯化钙和碱石灰,答案选BD。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】常用药品柳胺酚的合成路线如图。

已知:①![]() ;
;
②![]() (R代表烷基)
(R代表烷基)![]() ;
;
③当苯环上连有羧基,在苯环上引进的新取代基易进入羧基的间位。
回答下列问题:
(1)柳胺酚的分子式为__,F含有的官能团名称是__。
(2)A的名称为____。
(3)A→B所需试剂为___;D→E的反应类型为___。
(4)B→C的化学方程式为___。
(5)F的同分异构体中既能与FeCl3溶液发生显色反应,又能发生银镜反应的共有__种,其中能发生水解反应,核磁共振氢谱显示4组峰,其峰面积之比为1∶2∶2∶1的同分异构体的结构简式是___。
(6)写出以甲苯为原料(其他无机试剂任选)制备高聚物 的合成路线。__。
的合成路线。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
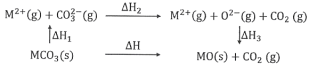
下列说法正确的是
A.△H1(CaCO3)>△H1(MgCO3)>0
B.△H2(MgCO3)>△H2(CaCO3)>0
C.△H1(CaCO3)-△H1(MgCO3)=△H3(CaO)-△H3(MgO)
D.对于MgCO3和CaCO3,△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
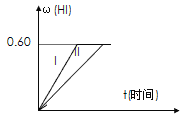
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。
(1)下列关于烃A和烃B的说法中不正确的是_____(填字母编号)。
a、烃A和烃B可能互为同系物
b、烃A和烃B可能互为同分异构体
c、当m=12时,烃A一定为烷烃
d、当n=11时,烃B可能的分子式有两种
e、烃A和烃B可能都为芳香烃
(2)若烃A为链状烃,且分子中所有碳原子都在一条直线上,则A的结构简式为____。
(3)若烃A为链状烃,分子中所有碳原子不可能都在同一平面上。在一定条件下,1mol A最多只能与1mol H2发生加成反应。写出烃A的名称:_______。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量浓硫酸,浓硫酸增重1.26g,再通过足量碱石灰,碱石灰增重4.4g,则烃B的分子式为______。
(5)有机物CH3CH(C2H5)CH(CH3)(CH2)3 CH3的系统命名是_______,1mol该有机物完全燃烧需消耗标准状况下氧气___L。
(6)请写出下列化合物所含官能团的名称:
①CH3CH=CH2:______; ②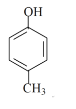 :______; ③
:______; ③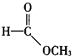 :______。
:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:

(1)请写出一种海水淡化的方法:__。
(2)步骤Ⅰ获取Br2的离子方程式为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是__(填化学式)。若反应中生成2molHBr,则消耗___molSO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:

下列说法正确的是
A. “灼烧”可在石英坩埚中进行
B. 母液中的溶质是K2CO3、KHCO3、KCl
C. “结晶”环节采用加热蒸发结晶的方法
D. “转化”反应中,生成的KMnO4和MnO2的物质的量之比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在可持续发展和能源的综合利用作出了巨大贡献。煤、石油、天然气这些化石能源如何更好的综合利用,相关技术日益成熟,请回答下列问题:
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为___;
②下列能增大碳的转化率的措施是___;(填写相应字母)
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
根据表中数据:
①计算反应CO2(g)+H2(g)![]() CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
②反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
③已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是![]()
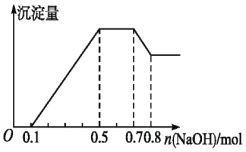
A.溶液中的阳离子有![]() 、
、![]() 、
、![]() 、
、![]()
B.溶液中![]() mol
mol
C.溶液中一定不含![]() ,可能含有
,可能含有![]()
D.![]() :
:![]() :
:![]() :2:1
:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com