
【题目】化学在可持续发展和能源的综合利用作出了巨大贡献。煤、石油、天然气这些化石能源如何更好的综合利用,相关技术日益成熟,请回答下列问题:
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为___;
②下列能增大碳的转化率的措施是___;(填写相应字母)
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
根据表中数据:
①计算反应CO2(g)+H2(g)![]() CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
②反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
③已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
【答案】K=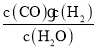 BC 0.62 吸热 没有 >
BC 0.62 吸热 没有 >
【解析】
(1)①平衡常数表达式是生成物浓度幂之积比反应物浓度幂之积,固体和纯液体不代入表达式;
②在不改变碳的量情况下,改变条件使平衡正向移动;
(2)①温度为973K时,Fe(s)+CO2(g)![]() FeO(s)+CO(g)①、Fe(s)+H2O(g)
FeO(s)+CO(g)①、Fe(s)+H2O(g)![]() FeO(s)+H2(g)②,将方程式①-②得反应CO2(g)+H2(g)
FeO(s)+H2(g)②,将方程式①-②得反应CO2(g)+H2(g)![]() CO(g)+H2O(g),则CO2(g)+H2(g)
CO(g)+H2O(g),则CO2(g)+H2(g) ![]() CO(g)+H2O(g)K=
CO(g)+H2O(g)K=![]() ;
;
②结合反应CO2(g)+H2(g)![]() CO(g)+H2O(g)在1173K时的平衡常数,判断平衡移动的方向,确定△H;
CO(g)+H2O(g)在1173K时的平衡常数,判断平衡移动的方向,确定△H;
③计算此时的浓度商和平衡常数比较判断反应进行的方向。
(1)①根据C(s)+H2O(g)![]() CO(g)+H2(g)可知平衡常数表达式为:K=
CO(g)+H2(g)可知平衡常数表达式为:K=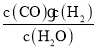 ;
;
②A.加入C(s),平衡不移动,故A错误;
B.加入H2O(g),平衡正向移动,碳的转化率变大,故B正确;
C.正反应是吸热反应,升高温度,平衡正向移动,碳的转化率变大,故C正确;
D.增大压强,平衡逆向移动,碳的转化率变小,故D错误;
故选BC;
(2)①温度为973K时,Fe(s)+CO2(g) ![]() FeO(s)+CO(g)①、Fe(s)+H2O(g)
FeO(s)+CO(g)①、Fe(s)+H2O(g) ![]() FeO(s)+H2(g)②,将方程式①-②得反应CO2(g)+H2(g)
FeO(s)+H2(g)②,将方程式①-②得反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),则CO2(g)+H2(g)
CO(g)+H2O(g),则CO2(g)+H2(g) ![]() CO(g)+H2O(g)的K=
CO(g)+H2O(g)的K=![]() =
=![]() =0.62;
=0.62;
②反应CO2(g)+H2(g)![]() CO(g)+H2O(g)在1173K时的平衡常数K=
CO(g)+H2O(g)在1173K时的平衡常数K=![]() =
=![]() =1.29>0.62,说明温度升高,平衡常数增大,反应正向移动,△H>0,即正反应为吸热反应;
=1.29>0.62,说明温度升高,平衡常数增大,反应正向移动,△H>0,即正反应为吸热反应;
③已知在T℃时,CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1molL-1,c始(H2O)=1molL-1,某时刻经测定CO的转化率为10%,反应的CO浓度为0.1mol/L,则
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1molL-1,c始(H2O)=1molL-1,某时刻经测定CO的转化率为10%,反应的CO浓度为0.1mol/L,则
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 1 1 0 0
变化浓度(mol/L) 0.1 0.1 0.1 0.1
某时刻浓度(mol/L) 0.9 0.9 0.1 0.1
则该反应的浓度商Qc=![]() =0.012<K=0.32,反应未达到平衡状态,反应正向进行,v正>v逆。
=0.012<K=0.32,反应未达到平衡状态,反应正向进行,v正>v逆。


科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入一定量SO2和O2进行反应: 2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,图甲表示反应速率(v)与温度(T) 的关系、图乙表示 T1 时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法正确的是( )
2SO3(g) ΔH<0,图甲表示反应速率(v)与温度(T) 的关系、图乙表示 T1 时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法正确的是( )
图甲 ,图乙
,图乙
A.图甲中,曲线1表示正反应速率与温度的关系
B.图乙中,a、b两点的反应速率:v(a)>v(b)
C.图甲中,d点时,混合气体的平均摩尔质量不再改变
D.图乙中,c点的正、逆反应速率:v(逆) < v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
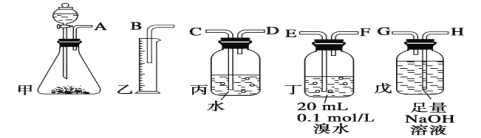
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是_______(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项)。
A.
B.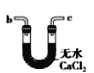
C.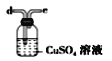
D.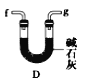
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较下列四组△H(所有的△H均小于0)的大小,其中△H2<△H1的是( )
A.4Al(s)+3O2(g)=2Al2O3(s) △H1 4Fe(s) +3O2(g)=2Fe2O3(s) △H2
B.C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
C.S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
D.A(g) +B(g)=C(g) △H1 A(g)+B(g)=C(l) △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应aA(g)+bB(g)![]() cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )
cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )

A.图甲中,若p1>p2,则在较低温度下有利于该反应自发进行
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸进行中和热的测定,测定稀硫酸和稀氢氧化钠溶液反应的中和热的实验装置如图所示:

(1)仪器A的名称为___。
(2)装置中碎泡沫塑料的作用是___。
(3)写出表示该反应中和热的热化学方程式(中和热为57.3kJ·mol-1):___。
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
1 | H2SO4 | NaOH | 平均值 | ||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差平均值为___℃。
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则中和热△H=-53.5kJ/mol。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表达正确的是( )
A. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
B. 邻硝基甲苯的结构简式为![]() ,能发生取代反应
,能发生取代反应
C. 钾长石(KAlSi3O8)写成氧化物形式为:K2OAl2O36SiO2
D. 反应的电子转移情况: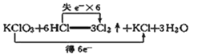
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,氧元素的质量分数为31.58%。A遇FeCl3溶液显紫色,A能与NaHCO3溶液反应,其苯环上的一氯取代物有两种,请回答下列问题:
(1)A的分子式是_______________________________。
(2)A的结构简式为________________________________________。
(3)A可以发生如图所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式________。

(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点290 ℃,熔点18.17 ℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度。甲、乙两装置相比较,乙装置有哪些优点________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述②溶液中再滴加![]() 溶液,产生白色沉淀;④
溶液,产生白色沉淀;④![]() 取③中上层清液继续滴加
取③中上层清液继续滴加![]() 溶液至无沉淀时,再滴加
溶液至无沉淀时,再滴加![]() 溶液,产生白色沉淀。根据实验以下推测正确的是
溶液,产生白色沉淀。根据实验以下推测正确的是
A.一定有![]() 离子B.不一定有
离子B.不一定有![]() 离子
离子
C.不能确定![]() 离子是否存在D.不能确定
离子是否存在D.不能确定![]() 离子是否存在
离子是否存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com