
A、 验证化学能转化为电能 |
B、 比较硫、碳、硅三种元素的非金属行强弱 |
C、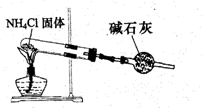 实验室制取NH3 |
D、 分离沸点不同且互溶的液体混合物 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、x=2 |
| B、该反应是吸热反应 |
| C、P3>P4,y轴表示B的转化率 |
| D、P3<P4,y轴表示混合气体的密度. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍.请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍.请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):2- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验 | 装置或仪器 |
| A | 分离乙酸乙酯中混有的乙酸 |  |
| B | 用已知浓度NaOH滴定未知浓度盐酸 |  |
| C | 从KI和I2的固体混合物中回收I2 |  |
| D | 配制100mL 0.100 0mol?L-1 NaOH溶液 | 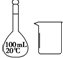 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、用湿润的淀粉碘化钾试纸鉴别Br2(g)和NO2 |
| C、用CO2鉴别NaAlO2溶液和CH3COONa溶液 |
| D、用KOH溶液鉴别SO3(g)和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验方案 | 现象 | 结论 |
| A |  | 向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 | 该装置的气密性良好 |
| B |  | 脱脂棉燃烧 | Na2O2与水反应生成氢氧化钠和氧气 |
| C |  | 烧杯①的澄清石灰水先变浑浊 | NaHCO3比Na2CO3受热更易分解 |
| D | 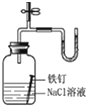 | U形管右端的液面高 | 铁钉发生吸氧腐蚀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| 反应Ⅰ |
| CO(NH2)2 |
| 反应Ⅱ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3?H2O③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② |
| B、将0.1 mol?L-1的NaHS和0.1 mol?L-1Na2S溶液等体积混合:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S) |
| C、将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液:c(CH3COO-)+c(OH-)=0.10 mol?L-1 |
| D、已知HClO+Na2CO3=NaClO+NaHCO3,在等物质的量浓度等体积次氯酸溶液与碳酸钠溶液混合溶液中:c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、①② | B、②③ |
| C、②③④ | D、①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com