
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍.请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍.请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):2- 2 |
| 5-1-2 |
| 2 |
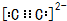 ,O原子最外层电子排布式为2s22p4,
,O原子最外层电子排布式为2s22p4,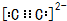 ;2s22p4;
;2s22p4;| 5-1×3 |
| 2 |
| 72g |
| NA |
| 36 |
| ρa3 |
| 36 |
| ρa3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加 | ①若无明显现象,证明固体中不含 ②若出现 |
| 步骤3:向B试管中滴加 | 若溶液中出现白色沉淀,则证明含有氯元素的盐;结合步骤2中①,则假设1成立;结合步骤2中②,则假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
| B、25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂 |
| C、25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强 |
| D、25℃时,NH4++H2O?NH3?H2O+H+的平衡常数为5.6×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染 |
| B、氯气是塑料、合成橡胶、合成纤维、农药、染料及药品的重要原料 |
| C、硅陶瓷和碳纤维复合制成的材料是一种新型无机非金属材料 |
| D、用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮氧化合物与碳氢化合物经紫外线照射可发生反应形成有毒烟雾 |
| B、绿色化学的核心是应用化学原理对环境污染进行治理 |
| C、雾霾中含有大量超标的主要物质是二氧化硫 |
| D、食盐中的Na+的焰色反应呈黄色,属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分馏、蒸馏、煤的液化都是物理变化,干馏、裂化、裂解都是化学变化 |
| B、乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 |
| C、需要加热的反应不一定是吸热反应 |
| D、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 验证化学能转化为电能 |
B、 比较硫、碳、硅三种元素的非金属行强弱 |
C、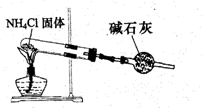 实验室制取NH3 |
D、 分离沸点不同且互溶的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,10 mL 0.02 mol?L-1 HCl溶液与10 mL 0.02 mol?L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| B、常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 |
| C、在0.1 mol?L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+) |
| D、常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com