
| A、分馏、蒸馏、煤的液化都是物理变化,干馏、裂化、裂解都是化学变化 |
| B、乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 |
| C、需要加热的反应不一定是吸热反应 |
| D、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |


科目:高中化学 来源: 题型:
 可用来制备抗凝血药,通过下列路线合成.
可用来制备抗凝血药,通过下列路线合成.
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍.请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍.请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):2- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| B、煤经过气化和液化等物理变化可以转化为清洁燃料 |
| C、多糖、油脂、蛋白质均能发生水解反应 |
| D、浸泡过高锰酸钾溶液的硅藻土可以吸收乙烯,所以可用此物保鲜水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验 | 装置或仪器 |
| A | 分离乙酸乙酯中混有的乙酸 |  |
| B | 用已知浓度NaOH滴定未知浓度盐酸 |  |
| C | 从KI和I2的固体混合物中回收I2 |  |
| D | 配制100mL 0.100 0mol?L-1 NaOH溶液 | 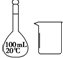 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、用湿润的淀粉碘化钾试纸鉴别Br2(g)和NO2 |
| C、用CO2鉴别NaAlO2溶液和CH3COONa溶液 |
| D、用KOH溶液鉴别SO3(g)和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| 反应Ⅰ |
| CO(NH2)2 |
| 反应Ⅱ |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com