
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)制备精细化工产品PbSO4·3PbO·H2O(三盐)的主要流程如下:
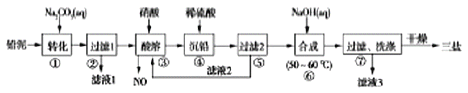
已知:常温下,Ksp(PbSO4)≈1.0×10-8,Ksp(PbSO4)≈1.0×10-13
回答下列问题:
(1)铅蓄电池在生活中有广泛应用,其工作原理是:Pb+PbO+2H2SO4![]() 2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为__________。若铅蓄电池放电前,正、负极质量相等,放若电时转移了lmol电子,则理论上两电极质量之差为_____________。
2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为__________。若铅蓄电池放电前,正、负极质量相等,放若电时转移了lmol电子,则理论上两电极质量之差为_____________。
(2)将滤液1、滤液3合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为________________。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO的离子方程式为________________;滤液2中溶质的主要成分为_____________(写化学式)。
(4)步骤⑥合成三盐的化学方程式为______________。
(5)步骤⑦洗涤的操作是________________________________。
(6)在步骤①的转化中,若硫酸铅和碳酸铅在浊液中共存,则![]() =________。
=________。
【答案】 PbSO4+2H2O-2e-=PbO2+SO42-+4H+ 16g Na2SO4·10H2O 3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O HNO3 4PbSO4+6NaOH![]() PbSO4·3PbO·H2O↓+3Na2SO4+2H2O 沿玻璃棒继续向漏斗中加入蒸馏水至刚好浸没沉淀,待水自然流下后重复操作2~3次 2.0×105
PbSO4·3PbO·H2O↓+3Na2SO4+2H2O 沿玻璃棒继续向漏斗中加入蒸馏水至刚好浸没沉淀,待水自然流下后重复操作2~3次 2.0×105
【解析】(1)铅蓄电池在充电时,阳极上发生氧化反应,电极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+ ;放电时,正极的电极反应式为PbO2+2e-+ SO42-+4H+![]() PbSO4+2H2O;负极的电极反应式为Pb-2e-+ SO42-
PbSO4+2H2O;负极的电极反应式为Pb-2e-+ SO42-![]() PbSO4;若转移2mol电子,则正极材料净增质量为m(PbSO4)-m(PbO2);负极材料净增质量为m(PbSO4)-m(Pb),两极质量之差为m(O2)=32 g。所以,放电时转移1mol电子,两极质量之差为16 g;正确答案:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ ; 16g。
PbSO4;若转移2mol电子,则正极材料净增质量为m(PbSO4)-m(PbO2);负极材料净增质量为m(PbSO4)-m(Pb),两极质量之差为m(O2)=32 g。所以,放电时转移1mol电子,两极质量之差为16 g;正确答案:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ ; 16g。
(2)滤液Ⅰ和滤液Ⅲ中的主要溶质是Na2SO4,由相对分子质量Mr=322知,析出的结晶水合物为Na2SO4·10H2O;正确答案:Na2SO4·10H2O 。
(3)铅与硝酸反应类似铜与硝酸反应,铅与硝酸反应的离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O ;沉铅涉及的反应为Pb(NO3)2+H2SO4![]() PbSO4↓+2HNO3,所以滤液Ⅱ中的溶质主要是HNO3;正确答案:3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;HNO3。
PbSO4↓+2HNO3,所以滤液Ⅱ中的溶质主要是HNO3;正确答案:3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;HNO3。
(4)硫酸铅与NaOH溶液加热反应,合成三盐的化学方程式为4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O↓+3Na2SO4+2H2O;正确答案:4PbSO4+6NaOH
3PbO·PbSO4·H2O↓+3Na2SO4+2H2O;正确答案:4PbSO4+6NaOH![]() PbSO4·3PbO·H2O↓+3Na2SO4+2H2O。
PbSO4·3PbO·H2O↓+3Na2SO4+2H2O。
(5) 对沉淀进行洗涤的操作为:沿玻璃棒继续向漏斗中加入蒸馏水至刚好浸没沉淀,待水自然流下后重复操作2~3次;正确答案:沿玻璃棒继续向漏斗中加入蒸馏水至刚好浸没沉淀,待水自然流下后重复操作2~3次。
(6)PbSO4(s)+CO32-(aq)![]() PbCO3(s)+ SO42-(aq),K=
PbCO3(s)+ SO42-(aq),K=![]() = Ksp(PbSO4)/Ksp(PbCO3)=2×10-8/10-13=2.0×105;正确答案:2.0×105。
= Ksp(PbSO4)/Ksp(PbCO3)=2×10-8/10-13=2.0×105;正确答案:2.0×105。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
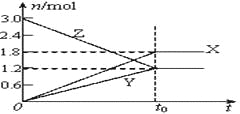
A. 该反应的化学方程式为:3X+2Y![]() 2Z
2Z
B. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、R 原子序数依次增大。由W、X、Y、R组成的一种化合物a在加热时完全分解为三种产物,其中一种产物b是能使品红溶液褪色的气体,另一种产物c是能使湿润的红色石蕊试纸变蓝的气体。金属单质Z在空气中燃烧生成的化合物可与水发生反应生成气体。下列说法正确的是
A. 简单离子的半径: X < Z < R
B. X的简单氢化物比Y的稳定
C. a、b、c中均含有极性共价健,且 a属于电解质,b和c都属于非电解质
D. W、X、Y、R四种元素形成的化合物一定会促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
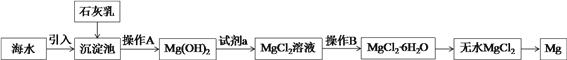
操作A是____________,下列仪器中操作B必须使用的有__________(填字母符号)。
A、锥形瓶 B、玻璃棒 C、表面皿 D、蒸发皿 E、坩埚
Ⅱ、乙醇镁[(CH3CH2O)2Mg] 为白色固体,难溶于乙醚和烃类,略溶于乙醇,在空气中会水解,常用作烯烃聚合催化剂载体和制备精密陶瓷的原料。某小组同学用镁粉(受潮会发生自燃、自爆)与乙醇在实验室中制备乙醇镁:
(1)干燥管中盛装的试剂为_____________,其作用为__________________________。
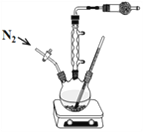
(2)下列操作的合理顺序为:______________。
a、将干燥的氮气通入装置,连续操作数次;
b、称取镁粉,量取无水乙醇加入反应器内;
c、加热回流,控制温度在80℃,反应1小时;
d、开启冷凝水和磁力搅拌器。
(3)将温度控制在80℃的原因是________________,写出生成乙醇镁的化学方程式____________________________。
(4)请你设计实验证明有乙醇镁生成(简述实验的方法):_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl=3Cl2+KCl +3H2O,
③2KBrO3+Cl2=Br2+ 2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的氧化物、卤化物以及硫酸盐均为重要化合物。
(1)氧化铁为红棕色粉末,该物质难溶于水,易溶于盐酸中,请写出该物质与盐酸反应的离子方程式______________________________。
(2)铁在氯气中剧烈燃烧,产生红棕色的烟,将燃烧所得的三氯化铁溶于水,所得溶液的质量分数为16.25%,其密度为6.0g· mL-1,则该溶液中氯离子的物质的量浓度为________________;将上述所配制的溶液稀释为0.15mol/L 的稀溶液480mL,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管之外,还需要________________;量取该溶液的体积是_______________mL;在配制过程中如果定容时俯视刻度线,会造成所配溶液浓度________(填“偏高”、“偏低”或“无影响”)。
(3)将饱和FeCl3溶液滴入沸腾的蒸馏水中,可以制得Fe(OH)3胶体,请写出该过程的化学反应方程式_______________________,以下关丁Fe(OH)3胶体的说法中不正确的有_____________(填序号。
A. Fe(OH)3胶体是一种红褐色、澄清、透明的混合物
B. Fe(OH)3胶体中分散质的微粒直径在10-9m~10-7m 之间
C.用渗析法鉴别Fe(OH)3胶体和FeCl3 溶液,用丁达尔效应分离Fe(OH)3胶体和FeCl3 溶液
D.取少量Fe(OH)3胶体置于试管中,向试管中逐滴滴加稀硫酸,可看到先产生红褐色沉淀,随后沉淀溶解,最终得到黄色的溶液
E.将其装入U 形管内,用石墨作电极,接通直流电,通电一段时间后发现靠近正极区附近的颜色逐渐变深
(4)在硫酸铁溶液中,逐滴加入等浓度的氢氧化钡溶液,其溶液的导电性随氢氧化钡溶液体积增加而变化的图象是(_______)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
A. 碳酸氢钠溶液直接蒸干得到碳酸氢钠固体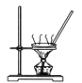
B. 制备Fe(OH)2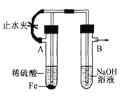
C. 除去CO2中含有的少量HCl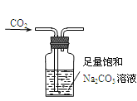
D. 配制100mL 0.1mol/L的稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2xH2O的化学方程式为______________________________。
(2)检验TiO2xH2O中Cl-是否被除净的方法是______________________________。
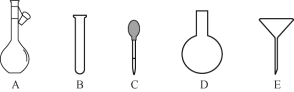
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是__________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的__________(填字母代号)。
(4)滴定终点的判定现象是________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗cmol/LNH4Fe(SO4)2 标准溶液VmL,则TiO2质量分数表达式为______________________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为周期表中部分元素的某种性质(X值)随原子序数变化的关系。

(1)短周期中原子核外p轨道上电子数与s轨道上电子总数相等的元素是________(写元素符号)。
(2)同主族内不同元素的X值变化的特点是 ________________,同周期内,随着原子序数的增大,X值变化的总趋势是________。周期表中X值的这种变化特点体现了元素性质的____________变化规律。
(3)X值较小的元素集中在元素周期表的________。
a.左下角 b.右上角 c.分界线附近
(4)下列关于元素该性质的说法中正确的是________(选填代号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映原子在分子中吸引电子的能力
c.X值大小可用来衡量元素金属性和非金属性的强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com