


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、两者的分散质都属于碱 |
| B、两者均为有色不透明的分散系 |
| C、两者分散质的直径都介于10-9~10-7m之间 |
| D、两者都有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
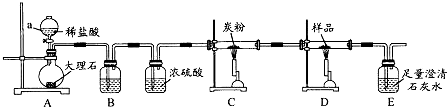
查看答案和解析>>
科目:高中化学 来源: 题型:
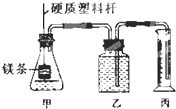 某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.
某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
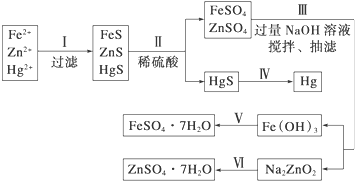 某工厂排出的污水中含有大量的Fe3+、Zn2+、Hg2+三种金属离子.以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4?7H2O)和汞的方案.
某工厂排出的污水中含有大量的Fe3+、Zn2+、Hg2+三种金属离子.以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4?7H2O)和汞的方案.查看答案和解析>>
科目:高中化学 来源: 题型:
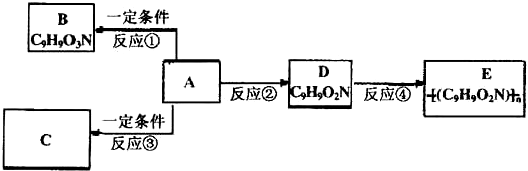
| 反应 | 反应类型 | 反应条件 |
| ② | ||
| A→B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
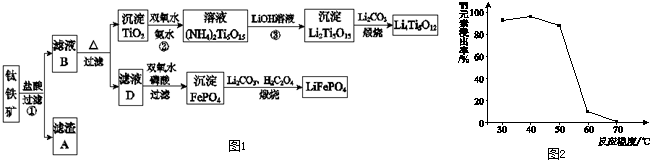
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com