
【题目】根据原子结构与性质的相关知识,请回答下列问题:
(1)基态S原子电子占据最高能层的符号是___________,最高能级的电子云轮廓图为___________形。
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。

(3)Fe3+基态核外电子排布式为___________
(4)根据元素周期律,原子半径As ________Se,电负性As________ Se (填“大于”或“小于”)
(5)元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1, ICu>INi的原因是___________
【答案】M 哑铃(纺锤) D C [Ar]3d5或1s22s22p63s23p63d5 大于 小于 铜失去的是全充满的3d10电子,镍失去的是4s1电子
【解析】
(1)基态S原子电子占据的最高能层是M层,占据该能层的电子中能量最高的电子为3p电子,3p电子的电子云在空间有3个伸展方向,原子轨道为哑铃形;
(2)基态能量最低,处于激发态能量高;
(3)Fe3+基态核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5。
(4)根据元素周期律,同周期从左到右原子半径逐渐减小,电负性逐渐增大;
(5)元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1, ICu>INi的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子。
(1)基态S原子电子占据的最高能层是M层,占据该能层的电子中能量最高的电子为3p电子,3p电子的电子云在空间有3个伸展方向,且相互垂直,原子轨道为哑铃形;
(2)基态能量最低,处于激发态能量高,能量1s<2s<2p;能量最低和最高的分别为D、C;
(3)Fe3+基态核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5。
(4)根据元素周期律,同周期从左到右原子半径逐渐减小,电负性逐渐增大;根据元素周期律,原子半径As 大于Se,电负性As小于Se ;
(5)元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1, ICu>INi的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子。


科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的![]() ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为__________________
(2)A、B、C三种元素电负性由大到小的顺序为_____________________(用元素符号表示),第一电离能D _______Al(填“>”“<”或“=”),其原因是___________________________。
(3)C元素的电子排布图为__________________;E3+的离子符号为__________________
(4)F元素位于元素周期表的______区,其基态原子的电子排布式为___________________
(5)G元素可能的性质_______________
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小于硒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A. 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO![]() 和OH-
和OH-
B. NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C. 10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图实验装置进行相应实验.装置正确且能达到实验目的是()
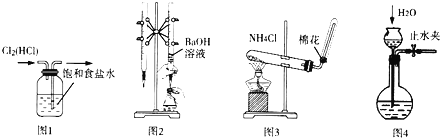
A.用图l所示装置除去![]() 中的HCl杂质
中的HCl杂质
B.用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度
C.用图3所示装置实验室制取![]()
D.用图4所小装置检查装置气密性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国和瑞典的科学家共同发现了治疗非典的新方法:吸入一氧化氮可快速改善重症非典患者的缺氧状况,缓解病情。病毒学研究同时证实,一氧化氮对非典病毒有直接抑制作用。下列有关NO的说法不正确的是()
A.NO可看作亚硝酸![]() 的酸酐
的酸酐
B.NO任意排放会造成大气污染
C.实验室制取NO气体可用排水法收集
D.氨催化氧化可生成NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的制备装置、制备时使用的原料与收集方法均正确的是( )
序号 | 物质 | 制备装置 | 制备时使用的原料 | 收集方法 | 序号 | 物质 | 制备装置 | 制备时使用的原料 | 收集方法 |
A |
|
|
| 排水法 | B | NO |
| 浓硝酸和金属铜 | 排空气法 |
C |
|
| 浓氨水和氢氧化钠固体 | 排空气法 | D |
|
| 乙醇和 | 排水法 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1 L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
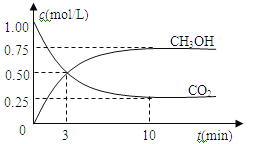
A.进行到3分钟时,正反应速率和逆反应速率相等
B.10分钟后容器中各物质浓度不再改变
C.达到平衡后,升高温度,正反应速率增大、逆反应速率减小
D.3min前v正>v逆,3min后v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成分为 ZnO,含少量 CuO 和 FeO)为原料,制取氯化锌晶体(ZnCl2xH2O) 的工艺流程如下:
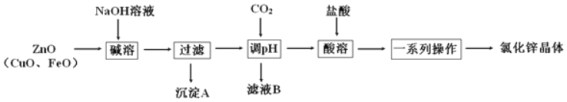 已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣。
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣。
(1)“调 pH”步骤中通入过量 CO2 时发生反应的离子方程式为_____。
(2)下列说法正确的是_____。
A.加入过量 NaOH 溶液的目的是提高锌元素的浸取率
B.沉淀 A 主要成分是 CuO、FeO
C.洗涤沉淀时,直接将洗涤液加入漏斗,并用玻璃棒轻轻搅拌
D.利用结晶法可以从氯化锌溶液中获得氯化锌晶体
(3)氯化锌晶体(ZnCl2xH2O)是白色晶体,可含 1、1.5、2.5、3、4个结晶水,易潮解,易溶于水,溶于乙醇、丙酮。由氯化锌晶体制备无水氯化锌的装置如图,其中滴液漏斗中盛放的是 SOCl2(SOCl2 熔点为﹣105℃、沸点 78.8℃、遇水剧烈水解生成两种酸性气体)。
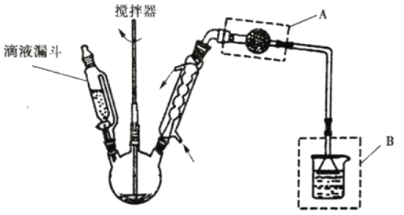
①下列物质中最适合洗涤氯化锌晶体的是_____。
A.冷水 B.浓盐酸 C.乙醇 D.氨水
②仪器 A 的名称为_____;装置 B 的作用是_____。
③以 ZnCl2H2O 为例,写出三颈烧瓶中发生反应的化学方程式_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com