
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的![]() ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为__________________
(2)A、B、C三种元素电负性由大到小的顺序为_____________________(用元素符号表示),第一电离能D _______Al(填“>”“<”或“=”),其原因是___________________________。
(3)C元素的电子排布图为__________________;E3+的离子符号为__________________
(4)F元素位于元素周期表的______区,其基态原子的电子排布式为___________________
(5)G元素可能的性质_______________
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小于硒
【答案】砷 F、O、N > Mg的3s处于全满状态较稳定 ![]() Fe3+ ds区 1s22s22p63s23p63d104s1或[Ar]3d104s1 A
Fe3+ ds区 1s22s22p63s23p63d104s1或[Ar]3d104s1 A
【解析】
属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大,A元素的价电子构型为nsnnpn+1,则n=2,故A为N元素;C元素为最活泼的非金属元素,则C为F元素;B原子序数介于氮、氟之间,故B为O元素;D元素核外有三个电子层,最外层电子数是核外电子总数的![]() ,最外层电子数为2,故D为Mg元素;E元素正三价离子的3d轨道为半充满状态,原子核外电子排布为1s22s22p63s23p63d64s2,则原子序数为26,为Fe元素;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,核外电子排布为1s22s22p63s23p63d104s1,故F为Cu元素;G元素与A元素位于同一主族,其某种氧化物有剧毒,则G为As元素。
,最外层电子数为2,故D为Mg元素;E元素正三价离子的3d轨道为半充满状态,原子核外电子排布为1s22s22p63s23p63d64s2,则原子序数为26,为Fe元素;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,核外电子排布为1s22s22p63s23p63d104s1,故F为Cu元素;G元素与A元素位于同一主族,其某种氧化物有剧毒,则G为As元素。
(1) G为As元素,G的元素名称为砷;
(2)同周期元素从左到右元素的电负性逐渐增强,故电负性F>O>N;Al价电子排布式为3s23p1,D为Mg元素,价电子排布式为3s2,Mg的3s处于全满状态较稳定,第一电离能Mg>Al;
(3) C为F元素,电子排布图为![]() ,E3+的离子符号为Fe3+;
,E3+的离子符号为Fe3+;
(4) F为Cu,位于周期表ds区,其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
(5)G为As元素,
A.As与Si位于周期表中金属与非金属分界线处,其单质可作为半导体材料,故A正确;
B.同一主族,从上到下,电负性减弱,As电负性比P小,故B错误;
C.As非金属性比P的弱,因磷酸为中强酸,则As的最高价氧化物对应的水化物是弱酸,故C错误;
D.砷元素位于VA族,P轨道为半充满状态,所以As第一电离能大于硒,故D错误;
故答案选A。


科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中发生可逆反应的平衡常数K=![]() 。当反应达到平衡时,n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
。当反应达到平衡时,n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
A.K值增大B.达到新平衡后,C的体积分数增大
C.平衡不移动D.达到新平衡后,vA比原平衡减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
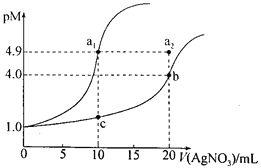
A. 该温度下,Ksp(Ag2CrO4)=4×10-12
B. al、b、c三点所示溶液中c(Ag+):al>b>c
C. 若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D. 用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 时,
时,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() 。
。
![]() 溶液和NaHA溶液反应的主要离子方程式为________________________________
溶液和NaHA溶液反应的主要离子方程式为________________________________![]() 不考虑
不考虑![]() 与
与![]() 发生氧化还原反应
发生氧化还原反应![]() 。
。
![]() 溶液中离子浓度由大到小的顺序为 ____________________________。
溶液中离子浓度由大到小的顺序为 ____________________________。
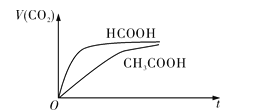
![]() 时,将
时,将![]() 的HCOOH溶液和
的HCOOH溶液和![]() 的
的![]() 溶液分别与
溶液分别与![]() 的
的![]() 溶液混合,实验测得产生的气体体积
溶液混合,实验测得产生的气体体积![]() 随时间
随时间![]() 变化的示意图如图所示:
变化的示意图如图所示:
![]() 的电离平衡常数表达式
的电离平衡常数表达式![]() __________________________。
__________________________。
![]() 反应初始阶段,两种溶液产生
反应初始阶段,两种溶液产生![]() 气体的速率存在明显差异的原因是__________________________________________________________________________________,反应结束后所得两溶液中,
气体的速率存在明显差异的原因是__________________________________________________________________________________,反应结束后所得两溶液中,![]() ____________
____________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 时,某溶液中含有
时,某溶液中含有![]() 、
、![]() 加入KOH固体以调节溶液
加入KOH固体以调节溶液![]() 忽略溶液体积的变化、忽略
忽略溶液体积的变化、忽略 ![]() 的挥发和分解
的挥发和分解![]() 。当pH为7时,能否有
。当pH为7时,能否有![]() 沉淀生成?________
沉淀生成?________![]() 填“能”或“否”
填“能”或“否”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,正确的是![]()
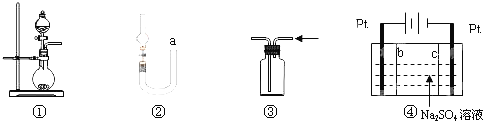
A.图![]() 可用于制取少量
可用于制取少量![]() 或用
或用![]() 和浓盐酸制取
和浓盐酸制取![]()
B.可用从a处加水的方法检验图![]() 装置的气密性
装置的气密性
C.实验室可用图![]() 的方法收集
的方法收集![]() 或
或![]()
D.利用图![]() 装置制硫酸和氢氧化钠,其中c为阴离子交换膜、b为阳离子交换膜
装置制硫酸和氢氧化钠,其中c为阴离子交换膜、b为阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将充有a mL NO和b mL NO2气体的试管倒立于水槽中,然后通入a mL O2。气体体积均在同温同压下测定,且b>a,则充分反应后,试管中气体在同温同压下的体积为( )
A.![]() mLB.
mLB.![]() mL
mL
C.![]() mLD.
mLD.![]() mL
mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是( )

A. 分子式为C17H23O6
B. 不能与FeCl3溶液发生显色反应
C. 在一定条件下可发生加成、取代、消去反应
D. 1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构与性质的相关知识,请回答下列问题:
(1)基态S原子电子占据最高能层的符号是___________,最高能级的电子云轮廓图为___________形。
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。

(3)Fe3+基态核外电子排布式为___________
(4)根据元素周期律,原子半径As ________Se,电负性As________ Se (填“大于”或“小于”)
(5)元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1, ICu>INi的原因是___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com