
����Ŀ����֪��![]() ʱ��
ʱ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��
![]() ��Һ��NaHA��Һ��Ӧ����Ҫ���ӷ���ʽΪ________________________________
��Һ��NaHA��Һ��Ӧ����Ҫ���ӷ���ʽΪ________________________________![]() ������
������![]() ��
��![]() ����������ԭ��Ӧ
����������ԭ��Ӧ![]() ��
��
![]() ��Һ������Ũ���ɴ�С��˳��Ϊ ____________________________��
��Һ������Ũ���ɴ�С��˳��Ϊ ____________________________��
![]() ʱ����
ʱ����![]() ��HCOOH��Һ��
��HCOOH��Һ��![]() ��
��![]() ��Һ�ֱ���
��Һ�ֱ���![]() ��
��![]() ��Һ��ϣ�ʵ���ò������������
��Һ��ϣ�ʵ���ò������������![]() ��ʱ��
��ʱ��![]() �仯��ʾ��ͼ��ͼ��ʾ��
�仯��ʾ��ͼ��ͼ��ʾ��
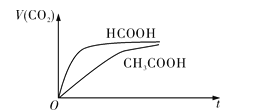
![]() �ĵ���ƽ�ⳣ������ʽ
�ĵ���ƽ�ⳣ������ʽ![]() __________________________��
__________________________��
![]() ��Ӧ��ʼ�Σ�������Һ����
��Ӧ��ʼ�Σ�������Һ����![]() ��������ʴ������Բ����ԭ����__________________________________________________________________________________����Ӧ��������������Һ�У�
��������ʴ������Բ����ԭ����__________________________________________________________________________________����Ӧ��������������Һ�У�![]() ____________
____________![]() ����
����![]() ����
����![]() ������
������![]() ��
��![]() ��
��
![]() ʱ��ij��Һ�к���
ʱ��ij��Һ�к���![]() ��
��![]() ����KOH�����Ե�����Һ
����KOH�����Ե�����Һ![]() ������Һ����ı仯������
������Һ����ı仯������ ![]() �Ļӷ��ͷֽ�
�Ļӷ��ͷֽ�![]() ����pHΪ7ʱ���ܷ���
����pHΪ7ʱ���ܷ���![]() �������ɣ�________
�������ɣ�________![]() ����������������
����������������![]() ��
��
���𰸡�![]()
![]()
![]() �����Ա�
�����Ա�![]() ǿ����Ũ�ȵ�HCOOH��Һ�е�
ǿ����Ũ�ȵ�HCOOH��Һ�е�![]() �ϴ�����Һ��
�ϴ�����Һ��![]() ��Һ�ķ�Ӧ���ʽϿ�
��Һ�ķ�Ӧ���ʽϿ� ![]() ��
��
��������
![]() ��
��![]() ��
��![]() ����
����![]() ������ƽ�ⳣ��Խ������Խǿ��ǿ����������
������ƽ�ⳣ��Խ������Խǿ��ǿ����������
��2��![]() ��Һ�д������������ˮ��������������ˮ�⣬�ҵ�һ��ˮ����ڵڶ���ˮ�⣬��Һ�ʼ��ԣ�
��Һ�д������������ˮ��������������ˮ�⣬�ҵ�һ��ˮ����ڵڶ���ˮ�⣬��Һ�ʼ��ԣ�
��3��![]() ���ݵ��뷽��ʽ��֪K=
���ݵ��뷽��ʽ��֪K=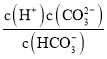 ��
��
![]() ��Ũ��Խ��Ӧ����Խ�죬������Һ����Խ������Ӧ���ɵ���Ӧ������Խ��ˮ�⣻
��Ũ��Խ��Ӧ����Խ�죬������Һ����Խ������Ӧ���ɵ���Ӧ������Խ��ˮ�⣻
��4������pHֵ��![]() ��������������Ũ�ȣ���
��������������Ũ�ȣ���![]() ���������ɳ���������pHֵ��
���������ɳ���������pHֵ��![]() ��������������Ũ�ȡ�
��������������Ũ�ȡ�
![]() ��
��![]() ��
��![]() ����
����![]() ������������Ƶ�
������������Ƶ�![]() ��ͬʱ������������������ӷ���ʽΪ��
��ͬʱ������������������ӷ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() ��Һ�д������������ˮ��������������ˮ�⣬�ҵ�һ��ˮ����ڵڶ���ˮ�⣬��Һ�ʼ��ԣ�������Ũ��Ϊ��
��Һ�д������������ˮ��������������ˮ�⣬�ҵ�һ��ˮ����ڵڶ���ˮ�⣬��Һ�ʼ��ԣ�������Ũ��Ϊ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() ̼��������ӵ��뷽��ʽΪ��
̼��������ӵ��뷽��ʽΪ��![]() �������ƽ�ⳣ������ʽΪK=
�������ƽ�ⳣ������ʽΪK=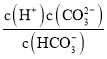 ���ʴ�Ϊ��
���ʴ�Ϊ��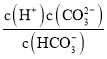 ��
��
![]() ����������HCOOH�ģ�������ͬŨ�ȵ������HCOOH��Һ��
����������HCOOH�ģ�������ͬŨ�ȵ������HCOOH��Һ��![]() ��Ũ�ȴ���
��Ũ�ȴ���![]() ��Һ��
��Һ��![]() ��Ũ�ȣ�Ũ��Խ��Ӧ����Խ�죬������Һ����Խ������Ӧ���ɵ���Ӧ������Խ��ˮ�⣬���Է�Ӧ������
��Ũ�ȣ�Ũ��Խ��Ӧ����Խ�죬������Һ����Խ������Ӧ���ɵ���Ӧ������Խ��ˮ�⣬���Է�Ӧ������![]() ���ʴ�Ϊ��HCOOH�����Ա�
���ʴ�Ϊ��HCOOH�����Ա�![]() ǿ����Ũ�ȵ�HCOOH��Һ�е�
ǿ����Ũ�ȵ�HCOOH��Һ�е�![]() �ϴ�����Һ��
�ϴ�����Һ��![]() ��Һ�ķ�Ӧ���ʽϿ죻
��Һ�ķ�Ӧ���ʽϿ죻![]() ��
��
![]() ��pHΪ7ʱ��
��pHΪ7ʱ��![]() ��SԪ�صĴ�����ʽΪ
��SԪ�صĴ�����ʽΪ![]() ��
��![]() ��
��![]() ����
����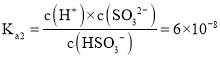 �������ɵ�
�������ɵ�![]() ��
��![]() ���������ɳ������ʴ�Ϊ���ܡ�
���������ɳ������ʴ�Ϊ���ܡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a��b��c��d�ĸ������缫���йص�ʵ��װ�ü�����ʵ���������£�
ʵ��װ�� |
|
|
����ʵ������ | a��������Сb���������� | b�������ݲ���c���ޱ仯 |
ʵ��װ�� |
|
|
����ʵ������ | d���ܽ�c�������ݲ��� | ������a������d�� |
�ɴ��ж������ֽ����Ļ��˳����(����)
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ĵ���Ԫ�أ����γɶ�����Ҫ�������ƻ�(As2S3)���ۻ�(As4S4)������(H3AsO4)��������(H3AsO3)�ȡ�
(1)�ۻƿ���ҩ����0.5mo1�ۻ���O2��Ӧ����As2O3��ת��14mol���ӣ�����һ�ֲ���Ϊ______________(�ѧʽ)��
(2)����(H3AsO4)��һ����Ҫ������Ʒ����������NaOH��Һ��Ӧ����Na3AsO4��NaH2AsO4��Һˮ�ⷴӦ��Kh=_________������Һ��______(����������������)�ԡ��������Һ�м�������NaOH���壬����Һ��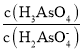 ��_______(����������������С������������)��(��֪��25�棬�����Ka1=5��10-3��Ka2=1.7��10-7)
��_______(����������������С������������)��(��֪��25�棬�����Ka1=5��10-3��Ka2=1.7��10-7)
(3)������(H3AsO3)�����������ư�Ѫ����������Һ�д��ڶ�������̬�������£���NaOH��Һ�ζ�H3AsO3ʱ�������������ʵ���������pH�ı仯��ͼ��ʾ��
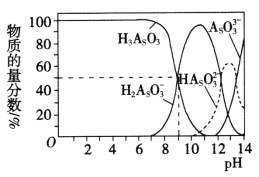
�Է�̪Ϊָʾ������NaOH��Һ��μ��뵽H3AsO3��Һ�У�����Һ����ɫ��Ϊ��ɫʱֹͣ�μӡ��ù�������Ҫ��Ӧ�����ӷ���ʽΪ_______________��pH=8ʱ����Һ�У�c(Na+)________c(H2AsO3��)(����>������<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ƶ�ʵ�鷽���ܴﵽ��Ӧʵ��Ŀ������������
ѡ�� | ʵ��Ŀ�� | ʵ�鷽�� |
A | �����ʷ����˱��� | ������Һ�м���CuCl2��(NH4)2SO4������Һ |
B | ֤����Ӧ���ʻ��淴Ӧ��Ũ�ȵ�������ӿ� | ��3mLϡ������������п��Ӧ�������������ʽ�����Ȼ�����1mL 1mol��L��1CuSO4��Һ��Ѹ�ٲ����϶����� |
C | �Ƚ�Ksp(BaCO3)��Ksp(BaSO4) | �����£���Na2CO3��Һ�м�����BaSO4��ĩ�����ˣ���ϴ���ij����м�ϡ���ᣬ�����ݲ��� |
D | ͨ���۲�Һ����жϸ�װ�õ������� |
|
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�ŷ���Ӱ������仯����Ҫ����֮һ���������ѧ�ҿ�����һ����ϵͳ�����ܽ⡱ˮ�еĶ�����̼���Դ����绯ѧ��Ӧ�����ɵ��ܺ��������乤��ԭ����ͼ��ʾ�������й�˵���в���ȷ���ǣ�������
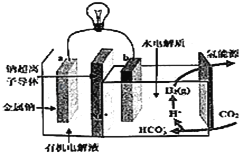
A. ϵͳ����ʱ����ѧ��ת��ɵ���
B. ϵͳ����ʱ��������a���ص�������b��
C. ϵͳ����ʱ��b�������ܻ���������
D. ϵͳ����ʱ��b�����ĵ缫��ӦʽΪ2CO2+2H2O+2e����2HCO3��+H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Y���п������������ã�����X�Ƶá�

�����йػ�����X��Y��˵����ȷ����
A. 1 mol X�������2 mol NaOH��Ӧ
B. Y���Ҵ�����������Ӧ�ɵõ�X
C. X��Y����������KMnO4��Һ��Ӧ
D. ������X��Y�ֱ�������Br2�ӳɵIJ������������̼ԭ����Ŀ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ǰ�����ڵ�A��B��C��D��E��F��G����Ԫ�أ�ԭ��������������AԪ�صļ۵��ӹ���Ϊnsnnpn+1��CԪ��Ϊ����õķǽ���Ԫ�أ�DԪ�غ������������Ӳ㣬�����������Ǻ������������![]() ��EԪ�����������ӵ�3d���Ϊ�����״̬��FԪ�ػ�̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��ӣ�GԪ����AԪ��λ��ͬһ���壬��ij���������о綾��
��EԪ�����������ӵ�3d���Ϊ�����״̬��FԪ�ػ�̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��ӣ�GԪ����AԪ��λ��ͬһ���壬��ij���������о綾��
(1)G��Ԫ������Ϊ__________________
(2)A��B��C����Ԫ�ص縺���ɴ�С��˳��Ϊ_____________________(��Ԫ�ط��ű�ʾ)����һ������D _______Al(����>����<������=��)����ԭ����___________________________��
(3)CԪ�صĵ����Ų�ͼΪ__________________��E3+�����ӷ���Ϊ__________________
(4)FԪ��λ��Ԫ�����ڱ���______�������̬ԭ�ӵĵ����Ų�ʽΪ___________________
(5)GԪ�ؿ��ܵ�����_______________
A���䵥�ʿ���Ϊ�뵼����� B����縺�Դ�����
C������������Ӧ��ˮ������ǿ�� D�����һ������С����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л���1-����-2��4-�����ϩ(![]() )��˵����ȷ����
)��˵����ȷ����
A. ��![]() ��Ϊͬϵ��B. ���ȴ�����3��
��Ϊͬϵ��B. ���ȴ�����3��
C. ����ԭ�Ӷ�����ͬһƽ����D. 1mol���л�����ȫȼ������5molO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ������ͼ��ʾ������Wԭ�ӵ���������������������������������˵������ȷ������ ��

A. ԭ�Ӱ뾶��W>Z>Y>X
B. ����������Ӧˮ�����������X>W>Z
C. �����̬�⻯������ȶ��ԣ�Y>X>W>Z
D. Ԫ��X��Z��W������ϼ۷ֱ����������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com