
【题目】某温度下,在密闭容器中发生可逆反应的平衡常数K=![]() 。当反应达到平衡时,n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
。当反应达到平衡时,n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
A.K值增大B.达到新平衡后,C的体积分数增大
C.平衡不移动D.达到新平衡后,vA比原平衡减慢
科目:高中化学 来源: 题型:
【题目】有机物W在医药和新材料等领域有广泛应用。W的一种合成路线如图:
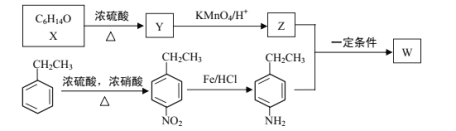
已知部分信息如下:
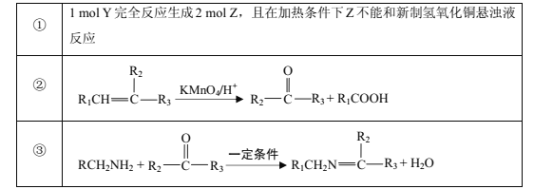
请回答下列问题:
(1)Y的化学名称是___;Z中官能团的名称是___;
(2)![]() 中___(填“有”或“无”)手性碳原子;图示中X转化为Y的反应类型是___。
中___(填“有”或“无”)手性碳原子;图示中X转化为Y的反应类型是___。
(3)生成W的化学方程式为___。
(4)G是对硝基乙苯的同分异构体,G能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G的同分异构体有___种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为1∶2∶2∶2∶2的结构简式为___。
(5)设计以苯乙烯和丙酮为原料制备药物中间体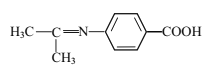 的合成路线___(无机试剂自选)。
的合成路线___(无机试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
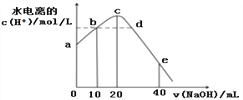
A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是_______________________________。
② 氨催化氧化生成一氧化氮反应的化学方程式是_____________________________。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:

① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_____________________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为_______mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
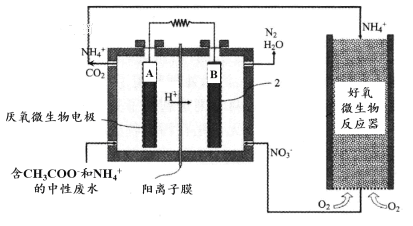
① 已知A、B两极生成CO2和N2,写出A极的电极反应式:______________________。
② 用化学用语简述NH4+去除的原理:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为![]()
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是水处理过程中常用的一种新型净水剂,在反应中被还原成Fe3+离子,工业上常用NaClO氧化Fe(OH)3生产高铁酸钠:
完成下列填空:
(1)配平上述化学方程式:___ Fe(OH)3 + ___ NaClO + ___ NaOH → ____ Na2FeO4 +___ NaCl +___ H2O
(2)其中发生还原反应的元素是__________;若制备过程中消耗了0.15 mol NaClO,则转移的电子数目是____________________。
(3)高铁酸钠之所以能净水,除了能杀菌消毒外,另一个原因是(结合离子方程式回答)_________________________________________________。
(4)生产高铁酸钠的另一种方法是电解法,原理是Fe + 2NaOH + 2 H2O → Na2FeO4 + 3 H2↑
则电解过程中Fe在_________。(选填编号)
a. 阳极发生氧化反应 b. 阴极发生还原反应
c. 阳极发生还原反应 d. 阴极发生氧化反应
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a_______0.16 (填“>”、“<”或“=”),判断的理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷是生命的第七元素,可形成多种重要化合物,如雌黄(As2S3)、雄黄(As4S4)、砷酸(H3AsO4)和亚砷酸(H3AsO3)等。
(1)雄黄可入药。若0.5mo1雄黄与O2反应生成As2O3,转移14mol电子,则另一种产物为______________(填化学式)。
(2)砷酸(H3AsO4)是一种重要化工产品,可与足量NaOH溶液反应生成Na3AsO4。NaH2AsO4溶液水解反应的Kh=_________,该溶液显______(填“酸”或“碱”)性。若向该溶液中加入少量NaOH固体,则溶液中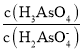 将_______(填“增大”、“减小”或“不变”)。(已知:25℃,砷酸的Ka1=5×10-3,Ka2=1.7×10-7)
将_______(填“增大”、“减小”或“不变”)。(已知:25℃,砷酸的Ka1=5×10-3,Ka2=1.7×10-7)
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。
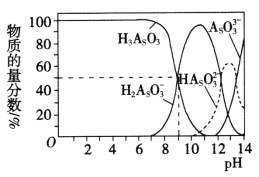
以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为_______________,pH=8时,溶液中,c(Na+)________c(H2AsO3-)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的![]() ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为__________________
(2)A、B、C三种元素电负性由大到小的顺序为_____________________(用元素符号表示),第一电离能D _______Al(填“>”“<”或“=”),其原因是___________________________。
(3)C元素的电子排布图为__________________;E3+的离子符号为__________________
(4)F元素位于元素周期表的______区,其基态原子的电子排布式为___________________
(5)G元素可能的性质_______________
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小于硒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com