
【题目】高铁酸钠(Na2FeO4)是水处理过程中常用的一种新型净水剂,在反应中被还原成Fe3+离子,工业上常用NaClO氧化Fe(OH)3生产高铁酸钠:
完成下列填空:
(1)配平上述化学方程式:___ Fe(OH)3 + ___ NaClO + ___ NaOH → ____ Na2FeO4 +___ NaCl +___ H2O
(2)其中发生还原反应的元素是__________;若制备过程中消耗了0.15 mol NaClO,则转移的电子数目是____________________。
(3)高铁酸钠之所以能净水,除了能杀菌消毒外,另一个原因是(结合离子方程式回答)_________________________________________________。
(4)生产高铁酸钠的另一种方法是电解法,原理是Fe + 2NaOH + 2 H2O → Na2FeO4 + 3 H2↑
则电解过程中Fe在_________。(选填编号)
a. 阳极发生氧化反应 b. 阴极发生还原反应
c. 阳极发生还原反应 d. 阴极发生氧化反应
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a_______0.16 (填“>”、“<”或“=”),判断的理由是______________________。
【答案】2 3 4 2 3 5 +1价氯元素 0.3NA 生成产物Fe3+发生水解,Fe3+ +3H2O ![]() Fe(OH)3+3H+,形成Fe(OH)3胶体吸附杂质。 a > 处理后溶液呈酸性,故c(H+) > c(OH—),根据电荷守恒,a> 0.16。
Fe(OH)3+3H+,形成Fe(OH)3胶体吸附杂质。 a > 处理后溶液呈酸性,故c(H+) > c(OH—),根据电荷守恒,a> 0.16。
【解析】
(1)根据电子守恒和元素守恒配平方程式;
(2)发生还原反应的元素化合价降低;
(3)水解生成胶体,胶体可吸附杂质;
(4)电解池中阳极失电子发生氧化反应,阴极得电子发生还原反应;
(5)根据电荷守恒分析。
(1)反应中铁元素化合价从+3价升高为+6价,升高3价,氯元素从+1价降为氯化钠中-1价,降2价,要使得失电子守恒,二者最小公倍数为6,则氢氧化铁系数为2,次氯酸钠系数为3,依据原子个数守恒,反应方程式:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;
故答案为:2;3;4;2;3;5;
(2)发生还原反应的元素化合价会降低,根据(1)可知+1价Cl元素化合价降低;根据方程式可知消耗0.15 mol NaClO转移电子数为0.3NA,
故答案为:+1价氯元素;0.3NA;
(3)高铁酸钠是水处理过程中常用的一种新型净水剂,在反应中被还原成Fe3+离子,Fe3+离子发生水解,Fe3+ +3H2O ![]() Fe(OH)3+3H+,形成Fe(OH)3胶体吸附杂质,
Fe(OH)3+3H+,形成Fe(OH)3胶体吸附杂质,
故答案为:生成产物Fe3+发生水解,Fe3+ +3H2O ![]() Fe(OH)3+3H+,形成Fe(OH)3胶体吸附杂质;
Fe(OH)3+3H+,形成Fe(OH)3胶体吸附杂质;
(4)根据原理Fe + 2NaOH + 2 H2O → Na2FeO4 + 3 H2↑可知Fe发生氧化反应,所以为阳极,故答案为:a;
(5)根据电荷可知:![]() ,即
,即![]() ,化简得:2a=0.32+ c(H+)-c(OH-),处理后溶液呈酸性,故c(H+) > c(OH—),所以a>0.16,
,化简得:2a=0.32+ c(H+)-c(OH-),处理后溶液呈酸性,故c(H+) > c(OH—),所以a>0.16,
故答案为:>;处理后溶液呈酸性,故c(H+) > c(OH—),根据电荷守恒,a> 0.16。


科目:高中化学 来源: 题型:
【题目】100 mL由氯化镁和氯化铝组成的混合液中c (Mg2+)为0.3 mol L-1,c (Cl-)为1.2 mol L-1。要使Mg2+全部转化为沉淀分离出来,则需加入1 mol L-1 NaOH溶液的体积不可能为
A.120 mLB.145 mLC.160 mLD.180 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法正确的是
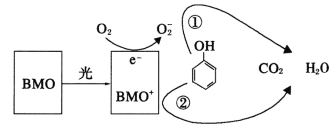
A.该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.该过程中BMO表现出较强氧化性
C.光催化降解过程中,光能转化为化学能、热能等
D.①和②中被降解的苯酚的物质的量之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中发生可逆反应的平衡常数K=![]() 。当反应达到平衡时,n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
。当反应达到平衡时,n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
A.K值增大B.达到新平衡后,C的体积分数增大
C.平衡不移动D.达到新平衡后,vA比原平衡减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体离子导体依靠离子迁移传导电流。如图是一种固体电池,Ag+可以在RbAg4I5晶体中迁移,空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池。下列说法错误的是( )
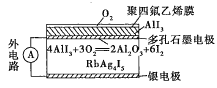
A.I2与Ag反应属于放热反应
B.Ag+从多孔石墨电极向银电极移动
C.多孔石墨电极为正极,银电极为负极
D.银电极的电极反应式为Ag-e-=Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )
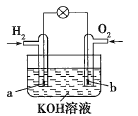
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
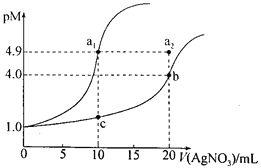
A. 该温度下,Ksp(Ag2CrO4)=4×10-12
B. al、b、c三点所示溶液中c(Ag+):al>b>c
C. 若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D. 用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将充有a mL NO和b mL NO2气体的试管倒立于水槽中,然后通入a mL O2。气体体积均在同温同压下测定,且b>a,则充分反应后,试管中气体在同温同压下的体积为( )
A.![]() mLB.
mLB.![]() mL
mL
C.![]() mLD.
mLD.![]() mL
mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com