
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法正确的是
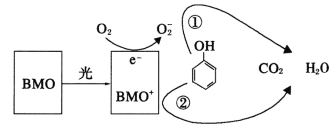
A.该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.该过程中BMO表现出较强氧化性
C.光催化降解过程中,光能转化为化学能、热能等
D.①和②中被降解的苯酚的物质的量之比为1:3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,
CO2(g)+H2(g) △H<0,
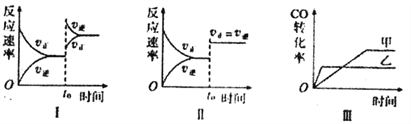
下列分析中正确的是
A. 图I研究的是t0时增大反应物浓度对反应速率的影响
B. 图II中t0时改变的条件只能是增大压强
C. 图III研究的是催化剂对化学平衡的影响,且乙使用了催化剂
D. 图III研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Kb(NH3·H2O)=1.8×10-5。该温度下,用0.100mol·L-1氨水滴定10.00mL0.100mol·L-1一元酸HA的溶液.滴定过程中加入氨水的体积(V)与溶液中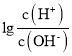 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是

A.HA为强酸
B.a=10
C.M点时,c(A-)>c(NH4+)>c(H+)>c(OH-)
D.当滴入20mL氨水时,溶液中存在c(NH4+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
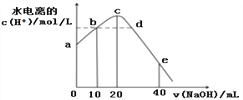
A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
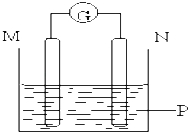
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是_______________________________。
② 氨催化氧化生成一氧化氮反应的化学方程式是_____________________________。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:

① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_____________________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为_______mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
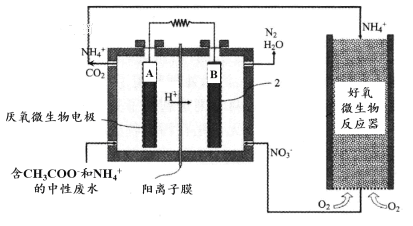
① 已知A、B两极生成CO2和N2,写出A极的电极反应式:______________________。
② 用化学用语简述NH4+去除的原理:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是水处理过程中常用的一种新型净水剂,在反应中被还原成Fe3+离子,工业上常用NaClO氧化Fe(OH)3生产高铁酸钠:
完成下列填空:
(1)配平上述化学方程式:___ Fe(OH)3 + ___ NaClO + ___ NaOH → ____ Na2FeO4 +___ NaCl +___ H2O
(2)其中发生还原反应的元素是__________;若制备过程中消耗了0.15 mol NaClO,则转移的电子数目是____________________。
(3)高铁酸钠之所以能净水,除了能杀菌消毒外,另一个原因是(结合离子方程式回答)_________________________________________________。
(4)生产高铁酸钠的另一种方法是电解法,原理是Fe + 2NaOH + 2 H2O → Na2FeO4 + 3 H2↑
则电解过程中Fe在_________。(选填编号)
a. 阳极发生氧化反应 b. 阴极发生还原反应
c. 阳极发生还原反应 d. 阴极发生氧化反应
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a_______0.16 (填“>”、“<”或“=”),判断的理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。下列有关说法中不正确的是( )
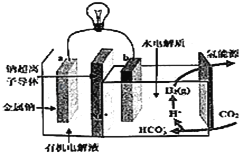
A. 系统工作时,化学能转变成电能
B. 系统工作时,电流由a极沿导线流向b极
C. 系统工作时,b极区可能会析出固体
D. 系统工作时,b极区的电极反应式为2CO2+2H2O+2e﹣=2HCO3﹣+H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com