
【题目】关于下列各实验装置的叙述中,正确的是![]()
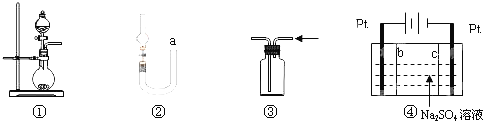
A.图![]() 可用于制取少量
可用于制取少量![]() 或用
或用![]() 和浓盐酸制取
和浓盐酸制取![]()
B.可用从a处加水的方法检验图![]() 装置的气密性
装置的气密性
C.实验室可用图![]() 的方法收集
的方法收集![]() 或
或![]()
D.利用图![]() 装置制硫酸和氢氧化钠,其中c为阴离子交换膜、b为阳离子交换膜
装置制硫酸和氢氧化钠,其中c为阴离子交换膜、b为阳离子交换膜
【答案】B
【解析】
A、图![]() 可以利用碱石灰
可以利用碱石灰![]() 或生石灰
或生石灰![]() 与浓氨水制取氨气,用
与浓氨水制取氨气,用![]() 和浓盐酸制取
和浓盐酸制取![]() 需要加热,缺少加热装置,不能用
需要加热,缺少加热装置,不能用![]() 和浓盐酸制取
和浓盐酸制取![]() ,故A不符合题意;
,故A不符合题意;
B、图![]() 关闭止水夹,从a处加水,U型管中产生液面差,静置一段时间,若液面差不变则气密性好,若不能形成液面差或液面差发生变化,则气密性不好,故B符合题意;
关闭止水夹,从a处加水,U型管中产生液面差,静置一段时间,若液面差不变则气密性好,若不能形成液面差或液面差发生变化,则气密性不好,故B符合题意;
C、氯气密度比空气的大,收集时应从长导管通入,而氨气的密度比空气的小,收集时应从短导管通入,故C不符合题意;
D、以Pt电解![]() 溶液,实际上是电解水,左侧为阳极区,右侧为阴极区,阳极放电的是
溶液,实际上是电解水,左侧为阳极区,右侧为阴极区,阳极放电的是![]() ,该极区
,该极区![]() 与阴离子交换膜交换的
与阴离子交换膜交换的![]() 形成
形成![]() 溶液,而阴极放电的是
溶液,而阴极放电的是![]() ,该极区的
,该极区的![]() ,与阳离子交换膜交换的
,与阳离子交换膜交换的![]() 形成NaOH溶液,故b为阴离子交换膜、c为阳离子交换膜,故D不符合题意;
形成NaOH溶液,故b为阴离子交换膜、c为阳离子交换膜,故D不符合题意;
故选B。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是_______________________________。
② 氨催化氧化生成一氧化氮反应的化学方程式是_____________________________。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:

① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_____________________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为_______mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
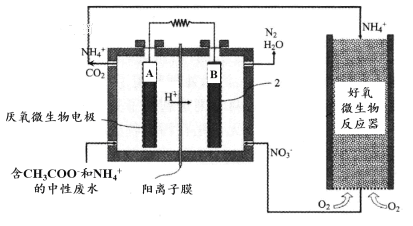
① 已知A、B两极生成CO2和N2,写出A极的电极反应式:______________________。
② 用化学用语简述NH4+去除的原理:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯(柠檬烯![]() )。提取柠檬烯的实验操作步骤如下:
)。提取柠檬烯的实验操作步骤如下:
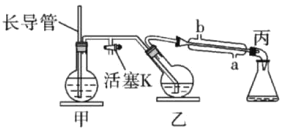
①将1~2个橙子皮剪成细碎的碎片,投入乙装置中,加入约30mL水;
②松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是
A. 当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B. 蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热
C. 为完成实验目的,应将甲中的长导管换成温度计
D. 要得到纯精油,还需要用到以下分离提纯方法:分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。下列有关说法中不正确的是( )
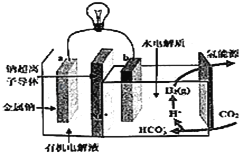
A. 系统工作时,化学能转变成电能
B. 系统工作时,电流由a极沿导线流向b极
C. 系统工作时,b极区可能会析出固体
D. 系统工作时,b极区的电极反应式为2CO2+2H2O+2e﹣=2HCO3﹣+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的![]() ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为__________________
(2)A、B、C三种元素电负性由大到小的顺序为_____________________(用元素符号表示),第一电离能D _______Al(填“>”“<”或“=”),其原因是___________________________。
(3)C元素的电子排布图为__________________;E3+的离子符号为__________________
(4)F元素位于元素周期表的______区,其基态原子的电子排布式为___________________
(5)G元素可能的性质_______________
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小于硒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,![]() 甲基
甲基![]() 中含有的中子数为
中含有的中子数为![]()
B.将![]() 溶于稀氨水中,所得溶液呈中性,则溶液中
溶于稀氨水中,所得溶液呈中性,则溶液中![]() 的数目为
的数目为![]()
C.![]() 和
和![]() 在催化剂和加热条件下充分反应生成NO的分子数为
在催化剂和加热条件下充分反应生成NO的分子数为![]()
D.常温下,![]() 的
的![]() 溶液中,发生电离的水分子数为
溶液中,发生电离的水分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72—还原为Cr3+。该反应的离子反应方程式为___________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施之一是__________________________ 。
②“水浸”要获得浸出液的操作是_________________________________。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为___。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是 _______。
(3)已知 Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数 Ksp=_______________。
(4)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() + H2O)。
+ H2O)。
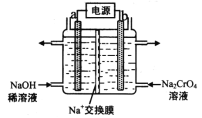
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为_________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 _______________mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图实验装置进行相应实验.装置正确且能达到实验目的是()
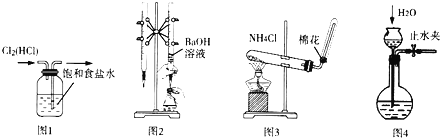
A.用图l所示装置除去![]() 中的HCl杂质
中的HCl杂质
B.用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度
C.用图3所示装置实验室制取![]()
D.用图4所小装置检查装置气密性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com