
【题目】“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
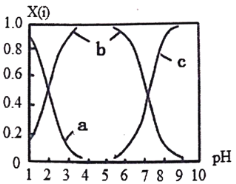
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
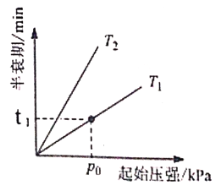
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)
【答案】2NO(g) +2CO(g)![]() N2(g) +2CO2(g) △H =-759.8 kJ/mol K12.K3/K2 c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) 亚硫酸氢根离子存在电离平衡HSO3-
N2(g) +2CO2(g) △H =-759.8 kJ/mol K12.K3/K2 c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) 亚硫酸氢根离子存在电离平衡HSO3-![]() H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大,pH减小。 1.0×10-3 20.0% > 1.25p0
H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大,pH减小。 1.0×10-3 20.0% > 1.25p0
【解析】
(1)由已知,反应①的△H=(812+1076-1490-632)kJ/mol=-234kJ/mol,根据盖斯定律,①×2+③-②得:2NO2(g)+2CO(g)![]() N2(g)+2CO2(g),△H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol;当总反应式相加时,平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,据此判断平衡常数关系;
N2(g)+2CO2(g),△H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol;当总反应式相加时,平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,据此判断平衡常数关系;
(2)①由图可得,pH=8时溶液中溶质主要为Na2SO3和NaHSO3,c(SO32-)>c(HSO3-),溶液中的主要离子为:Na+、SO32-、HSO3-,次要离子为OH-、H+,据此判断离子浓度大小顺序;
②NaHSO3溶液中HSO3-存在电离平衡HSO3-![]() H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大。
H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大。
(3) ①V=![]() 计算;
计算;
②根据△c=V△t,然后根据转化率![]() 计算;
计算;
③根据温度升高,反应速率加快,半衰期缩短;利用表格数据计算分析。
(1)由已知,反应①的△H=(812+1076-1490-632)kJ/mol=-234kJ/mol,根据盖斯定律,①×2+③-②得:2NO2(g)+2CO(g)![]() N2(g)+2CO2(g),△H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol,当总反应式相加时平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,所以平衡常数K=
N2(g)+2CO2(g),△H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol,当总反应式相加时平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,所以平衡常数K=![]() ;
;
(2)①由图可得,pH=8时溶液中溶质主要为Na2SO3和NaHSO3,c(SO32-)>c(HSO3-),溶液中的主要离子为:Na+、SO32-、HSO3-,次要离子为OH-、H+,离子浓度大小顺序为c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+);
②NaHSO3溶液中HSO3-存在电离平衡HSO3-![]() H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大,所以pH降低;
H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大,所以pH降低;
(3)①在0~40min时段,△c=(0.100mol/L-0.060mol/L)=0.040mol/L,所以化学反应速率v(N2O)=![]() = 1.0×10-3 mol/(L·min);
= 1.0×10-3 mol/(L·min);
②根据①可知化学反应速率为1.0×10-3 mol/(L·min),则30min内改变的浓度△c=V·△t=1.0×10-3 mol/(L·min) ×30min=0.0mol/L,所以N2O的转化率![]() =20%;
=20%;
③根据温度升高,反应速率加快,半衰期时间缩短。根据图示可知在压强不变时,半衰期T1<T2,说明温度T1>T2;
根据题干信息可知2N2O(g)![]() 2N2(g)+O2(g),反应开始时c(N2O)=0.100mol/L,当其浓度减小一半时,物质的浓度:c(N2O)=0.050mol/L,c(N2)=0.050mol/L,c(O2)=0.0250mol/L,此时物质的总浓度=0.050mol/L+0.050mol/L+0.0250mol/L=0.125mol/L,起始时的浓度为0.1mol/L,所以体系压强
2N2(g)+O2(g),反应开始时c(N2O)=0.100mol/L,当其浓度减小一半时,物质的浓度:c(N2O)=0.050mol/L,c(N2)=0.050mol/L,c(O2)=0.0250mol/L,此时物质的总浓度=0.050mol/L+0.050mol/L+0.0250mol/L=0.125mol/L,起始时的浓度为0.1mol/L,所以体系压强![]() p=1.25,所以P=1.25P0。
p=1.25,所以P=1.25P0。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 少量SO2气体通入次氯酸钠溶液中:SO2+3ClO-+H2O=SO42-+Cl-+2HClO
B. 氧化铁溶于HI溶液:Fe2O3+6H+=2Fe3++3H2O
C. 碳酸氢钠与过量Ba(OH)2溶液反应:HCO3-+OH-+Ba2+=BaCO3![]() +H2O
+H2O
D. 向硅酸钠水溶液中通入过量CO2气体:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。

回答下列问题:
(1)试剂Ⅰ的化学式为______,①中发生反应的离子方程式为_________。
(2)试剂Ⅱ的化学式为_______,②中加入试剂Ⅱ的目的是____________。
(3)试剂Ⅲ的名称是________,③中发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
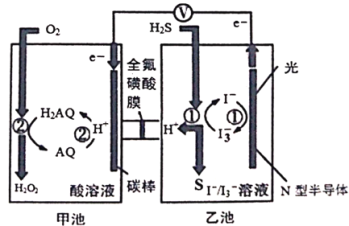
A. 甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物
B. 电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按化学反应中元素化合价是否发生变化,无机反应可以分为氧化还原反应和非氧化还原反应。这种分类方法与将无机反应按反应形式的不同分为四种基本反应类型是完全不同的分类方式,这二者的关系如图。

图中方框内区域表示所有的化学反应,大圆内区域表示氧化还原反应,大圆外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出:
(1)化学反应可以分为哪四种基本反应类型:___、___、___、___。
(2)若图中B圈表示化合反应,则:
B圈与氧化还原反应重叠的阴影部分表示哪一类反应?___________;
C圈与氧化还原反应重叠的阴影部分表示哪一类反应?______________;
请分别举出符合以上两种情况的一个例子:________; ___________。
(3)下列说法正确的是___。
A.置换反应一定属于氧化还原反应
B.有单质参加和有单质生成的化学反应一定是氧化还原反应
C.化学反应中有一种物质被氧化,必定有另外一种物质被还原
D.氧化还原反应发生的本质是化合价发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是()
A. 偏二甲肼(C2H8N2)的摩尔质量为60g
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C. 1mol偏二甲肼(C2H8N2)的质量为60g/mol
D. 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们应该从化学的角度认识生活中的问题,下列说法正确的是( )
A.生活污水不是化工废水,可向江河湖泊里任意排放
B.铵态氮肥与草木灰混合使用可以明显提高肥效
C.可以用灼烧闻气味的方法区分涤纶和羊绒
D.通过观察颜色和闻气味可以辨别保鲜膜成分是聚乙烯塑料还是聚氯乙烯塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) +Y(g)![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是( )
A. 反应前2min的平均速率v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,升高温度,反应达到新平衡前v(正)<v(逆)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子方程式中,属于水解反应的是
A. HCO3-+H2O H3O++CO32- B. NH3+H2O OH-+NH4+
C. AlO2- + 2H2O Al(OH)3 + OH- D. CO32-+H3O+ = H2O+HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com