
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
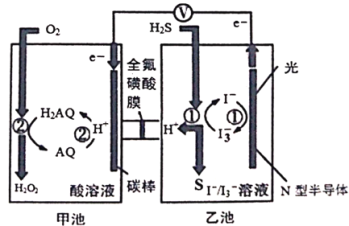
A. 甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物
B. 电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
【答案】B
【解析】
A.根据图示可知在甲池中O2与H2AQ反应产生H2O2和AQ,O元素的化合价降低,H元素化合价没有变化,所以H2O2是还原产物,A错误;
B.根据图示可知电路中每转移0.2mol电子,反应产生0.1molH2O2,溶液质量增加3.4g,而在乙池,H2S-2e-=S↓+2H+,产生的H+通过全氟碳酸膜进入甲池,所以乙池溶液质量保持不变,B正确;
C.在乙池中,H2S失电子生成硫单质,I2单质得电子生成I-,发生电池反应为H2S+I3-=3I-+S↓+2H+,不是电极反应式,C错误;
D.甲池中碳棒为正极,正极上发生还原反应,电极反应为:AQ+2H++2e-=H2AQ,D错误;
故合理选项是B。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:

下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度, 40 min时升高温度
D. 8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A由三种元素组成,某兴趣小组进行了如下实验:

已知:气体甲为纯净物且只含两种元素,在标况下体积为672 mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:
(1)A的组成元素为________(用元素符号表示);
(2)写出气体甲与NaOH(aq)反应的离子方程式________;
(3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物试写出相应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟用碱性烂版液(主要成分为[Cu(NH3)4]Cl2和Cu(OH)2)为原料制取摩尔盐,并回收铜单质,设计流程如下:

已知温度超过60℃时,FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式________。
(2)实验中第一步所用硫酸浓度为4 mol/L,不能太小,原因是________。
(3)关于该实验过程的下列说法中正确的是________。
A.所加铁粉应该现用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示

B.溶液A与铁粉反应温度若高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1 mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5-6之间,若pH过高,可用硫酸调节,以抑制Fe2+水解。
(4)为从溶液C得到较纯的摩尔盐,请选择下列合适的操作并排序________。
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净________。
(6)为了测定产品中摩尔盐(M = 392 g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.085 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L 0.1moL某一元酸HR溶液中逐渐加入BOH,若溶液温度和体积保持不变,所得混合溶液的与pH变化的关![]() 、
、![]() 系如图中M或N线所示。下列叙述正确的是
系如图中M或N线所示。下列叙述正确的是
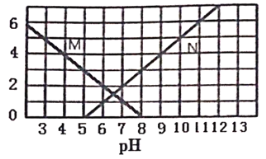
A. M线表示![]() 随pH的变化 B. 若温度升高,两条线均往上平移
随pH的变化 B. 若温度升高,两条线均往上平移
C. BR溶液呈碱性 D. 25℃,0.1 mol/L NaR溶液的pH约为10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
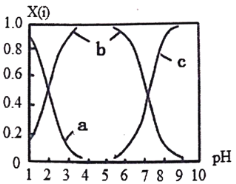
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
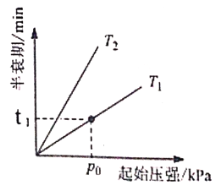
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向10mL.0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液。滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
(已知1g5=0.7)

A. x、y两点c(Ca2+)之比为2000:3 B. Ksp(CaCO3)=5×10-9
C. w点对应的分散系很稳定 D. x、y、z三点中,水的电离程度最大的为x点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0
B. 反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0
C. 若ΔH > 0,ΔS < 0,化学反应在任何温度下都能自发进行
D. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com