
����Ŀ��ijʵ��С�����ü����ð�Һ����Ҫ�ɷ�Ϊ[Cu(NH3)4]Cl2��Cu(OH)2��Ϊԭ����ȡĦ���Σ�������ͭ���ʣ�����������£�

��֪�¶ȳ���60��ʱ��FeSO4����Һ�����γ�FeSO4��H2O��ɫ���壬��һ��������������ʧ��Ħ����������ˮ���������Ҵ���
��ش��������⣺
��1��д��[Cu(NH3)4]Cl2��ϡ���ᷴӦ�����ӷ���ʽ________��
��2��ʵ���е�һ����������Ũ��Ϊ4 mol/L������̫С��ԭ����________��
��3�����ڸ�ʵ����̵�����˵������ȷ����________��
A����������Ӧ�����ñ���̼������Һ���ݳ�ȥ��������ۣ�Ȼ�������������룬������������ͼ��ʾ

B����ҺA�����۷�Ӧ�¶�������60�棬�ᵼ�»��յ�ͭ������
C������淋��������������ܽ�����۵������������ܽ�1 mol���ۣ������������ҲԼΪ1 mol
D����ҺB��pH������5-6֮�䣬��pH���ߣ�����������ڣ�������Fe2+ˮ�⡣
��4��Ϊ����ҺC�õ��ϴ���Ħ���Σ���ѡ�����к��ʵIJ���������________��
����������ˮϴ�� ���������϶ྦྷ����� ����Һ�м�����ˮ�Ҵ� �ܳ��ˢ���ȴ�ᾧ ����
��5����μ���Ħ�����Ѿ�ϴ�Ӹɾ�________��
��6��Ϊ�˲ⶨ��Ʒ��Ħ����(M = 392 g/mol)�ĺ�����ijͬѧ�÷�����ƽ��ȡ5.220 g�IJ�Ʒ������ƿ�У�������ȥ��ˮ�ܽ����0.085 mol/L������KMnO4��Һ�ζ����ζ�ʱ������ͼ����ò�Ʒ����Ϊ________��
���𰸡�Cu(NH3)42+ + 4H+ = Cu2+ + 4NH4+ ������Ũ��̫С����Ӧ����̫�����������ߣ�Ħ�����������ѣ� BD �ۢܢ٢� ȡ���һ��ϴ��Һ������������ᱵ��Һ�����ã����ϲ���Һ�еμ���������Һ������������������ϴ�� 83.3%
��������
��1��[Cu(NH3)4]Cl2Ϊ������ˮ��Һ�пɵ���[Cu(NH3)4]2+��Cl-���ݴ˷�����ϡ���ᷴӦ����ʽ��
��2����Ӧ���Ũ��̫С����Ӱ�췴Ӧ���ʣ��ݴ˷�������
��3��A. ������Һʱ��Ӧ����Һ���Ų���������©���У�
B. �¶ȳ���60��ʱ��FeSO4����Һ�����γ�FeSO4��H2O��ɫ���壻
C. ����Ԫ���غ����������֮��Ĺ�ϵʽ���з�����
D. ��ҺB�к���Fe2+��Fe2+��ˮ��Һ�п�ˮ�⣻
��4������������Ϣ�����ó��˵ķ�������Ħ���Σ�
��5��ͨ������ϴ��Һ�Ƿ����������������������ȷ��Ħ�����Ѿ�ϴ�Ӹɾ���
��6�����ݸ�������������������ӵķ�Ӧ����ʽ��������ص����ʵ������������Ʒ��Ħ���εĴ��ȡ�
��1��[Cu(NH3)4]Cl2��ϡ���ᷴӦ�����ӷ���ʽΪ��Cu(NH3)42+ + 4H+ = Cu2+ + 4NH4+��
�ʴ�Ϊ��Cu(NH3)42+ + 4H+ = Cu2+ + 4NH4+��
��2������һ�������Ũ��̫С�����Ƿ�Ӧ���ʽ��ͣ�ͬʱӰ��Ħ���ε��������������ԭ��Ϊ��������Ũ��̫С����Ӧ����̫�����������ߣ�Ħ�����������ѣ�
�ʴ�Ϊ��������Ũ��̫С����Ӧ����̫�����������ߣ�Ħ�����������ѣ�
��3��A����������Ӧ�����ñ���̼������Һ���ݳ�ȥ��������ۣ�Ȼ��������������ʱ�������������Ҫ�ò�������������A�����
B. ��ҺA�����۷�Ӧ�¶�������60�棬FeSO4����Һ�����γ�FeSO4��H2O��ɫ���壬��һ��������������ʧ�����չ������л��յ�ͭ����������B����ȷ��
C. ���õ���ҺB��������һ��������������ӣ�һ�����������ӣ����ܽ��������1 molʱ�����������淋����ʵ���ӦС��1 mol����C�����
D. ��ҺB��Fe2+����ˮ�⣬�������pH��5-6֮�䣬������Fe2+ˮ�⣬��D����ȷ��
��ѡBD��
��4������������֪��Ϣ��֪���������ҺC�õ��ϴ���Ħ���Σ��ɽ�Ħ��������ˮ�Ҵ���Ϻ���ˣ����������Ϊ���ۢܢ٢ޣ�
�ʴ�Ϊ���ۢܢ٢ޣ�
��5�������һ��ϴ��Һ������������ӡ������ӵĴ��ڣ���֤����ϴ�Ӹɾ���������������£�ȡ���һ��ϴ��Һ������������ᱵ��Һ�����ã����ϲ���Һ�еμ���������Һ������������������ϴ����
�ʴ�Ϊ��ȡ���һ��ϴ��Һ������������ᱵ��Һ�����ã����ϲ���Һ�еμ���������Һ������������������ϴ����
��6��ͨ�����������Կ�������Һ���ĵĸ�����ص����Ϊ��26.10 mL-0.00 mL = 26.10 mL��
�����ĸ�����ص����ʵ���Ϊ0.085 mol/L��26.10��10-3 L = 0.0022 mol��
���ݷ�Ӧ��5Fe2++MnO4+8H+ �T 5Fe3+ +Mn2+ +4H2O���������������ʵ���Ϊ��0.0022 mol��5 = 0.011 mol��
������Ʒ�к��е�Ħ���ε�����Ϊ��392 g/mol��0.011 mol = 4.348 g��
FeSO47H2O������������![]() ��100% = 83.3%��
��100% = 83.3%��
�ʴ�Ϊ��83.3%��


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д� Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(23V)����Ϊ���ִ���ҵζ�������������ڸ����У�������һ�������Ͻ����ʽ���ں��������Ļ����ﱻ�㷺����������ȼ�ϼ���صȡ��ҹ����Ѵ��������ϴ��������ϲ��������������������⣺
(1)���Ļ�̬ԭ�ӵļ۵����Ų�ͼΪ___________��
(2)����ij��������ľ����ṹ����ͼ1��ʾ�����������Ļ�ѧʽΪ___________�����۷е����ͼ3(Ϊ�ڱ����������Ľṹ)���ʵ��۷е�Ҫ___________(��ߡ����͡���ࡱ)��
(3)V2O5��һ�ֳ����Ĵ������ںϳ����ᡢ���ᡢ�ڱ�������������ϩ����ϩ�У���ʹ��������������������

�������������Ľṹ��ʽ����ͼ2��ʾ����ýṹ�к���___________���м���
���ڱ�ȩ( CH3CH2CHO)������̼ԭ�ӵ��ӻ���ʽ�ֱ�Ϊ___________��
��C��N��O��Ne��Ԫ�أ����һ�����ܴӴ�С��˳������Ϊ______________________��
��V2O5�ܽ���NaOH��Һ�У��ɵõ�������(Na3VO4)���о���VO43���ռ乹����ͬ��һ�������ӣ�___________(�����ӷ���)��
(4)��֪���ʷ��ľ���������������ѻ�����������ͼ4��ʾ�����跰ԭ��ֱ��Ϊd��10-7cm���������ԭ������ΪM�������ܶȵı���ʽΪ___________g��cm��3��(�谢���ӵ�����ΪNA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������������Ӻ������ӵ��Ӳ�ṹ��ͬ����( )
A. NaClB. MgF2C. MgCl2D. K2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦmA��g����nB��g��![]() pC��g����qD��g����10 min��ﵽƽ�⣬��ô�ʱA��Ũ�ȼ�����nmol/L��C��Ũ��������2n/3mol/L����֪��ƽ����Ӧ����VC=2VB���ﵽƽ����������¶Ȳ��䣬��С���������A��ת���ʲ��䣬��÷�Ӧ�Ļ�ѧ����ʽӦΪ
pC��g����qD��g����10 min��ﵽƽ�⣬��ô�ʱA��Ũ�ȼ�����nmol/L��C��Ũ��������2n/3mol/L����֪��ƽ����Ӧ����VC=2VB���ﵽƽ����������¶Ȳ��䣬��С���������A��ת���ʲ��䣬��÷�Ӧ�Ļ�ѧ����ʽӦΪ
A. 2A��g����6B��g��![]() 3C��g����5D��g��
3C��g����5D��g��
B. 3A��g����B��g��![]() 2C��g����2D��g��
2C��g����2D��g��
C. 3A��g����B��g��![]() 2C��g����D��g��
2C��g����D��g��
D. A��g����3B��g��![]() 3C��g����3D��g��
3C��g����3D��g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����Ʒ�к�������̼��ء�����غͲ�����ˮ�����ʡ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ٽ���Һ������ͼ��ʾ������в���(ע������������Լ�����������ڹ����Լ������ȥ���۲��������µ�����)��

�ش��������⣺
��1���Լ���Ļ�ѧʽΪ______�����з�����Ӧ�����ӷ���ʽΪ_________��
��2���Լ���Ļ�ѧʽΪ_______�����м����Լ����Ŀ����____________��
��3���Լ����������________�����з�����Ӧ�����ӷ���ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A�ɷ�����ͼ����ʾ�ķ�Ӧ��
д����Ӧ���ʵĻ�ѧʽ�����(���ڱ�����)��������д��������Ӧ�Ļ�ѧ����ʽ��
A | B | C | D | E | |
��ѧʽ | Cu | CuCl2 | ____ | ____ | ____ |
�� �� | _____ | _____ | �� | ������ | �� |

(1)______________________________��
(2)______________________________��
(3)______________________________��
(4)______________________________��
(5)______________________________��
(6)______________________________ ��
(7)______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ������Ȼ�������о�����ȡ�����½�չ��������ͼװ�ý���������������ת�������������֪�ס��ҳ��з����ķ�ӦΪ(��ͼ)������˵����ȷ����
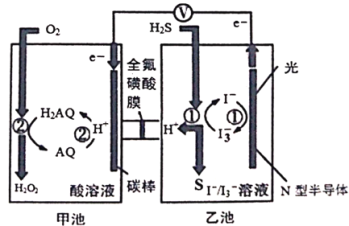
A. �׳��еõ�H2O2�ķ�Ӧ��H2O2������������Ҳ�ǻ�ԭ����
B. ��·��ÿת��0.2mol���ӣ��׳���Һ�����仯3.4g���ҳ���Һ�������ֲ���
C. ����ʱ�ҳص缫�Ϸ����ķ�ӦΪ��H2S+I3-=3I-+S+2H+
D. �׳���̿���Ϸ����ĵ缫��ӦΪ��AQ+2H+-2e-=H2AQ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ��������C2H8N2����һ�ָ���ȼ�ϣ�ȼ�ղ����ľ���������Ϊ�������ػ�����ƶ���������������ȷ���ǣ���
A. ƫ��������C2H8N2����Ħ������Ϊ60g
B. 6.02��1023��ƫ��������C2H8N2�����ӵ�����Ϊ60g
C. 1molƫ��������C2H8N2��������Ϊ60g/mol
D. 6gƫ��������C2H8N2������NA��ƫ��������C2H8N2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ݻ��̶��ķ�Ӧ���У���һ�����һ������ܷ���壬��������ֱ�������¿��淴Ӧ��2SO2��g��+O2(g) ![]() 2SO3(g)��3Fe(s)+4H2O(g)
2SO3(g)��3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)������м���SO2��O2��SO3�����ʵ����ֱ�Ϊxmol��3.25mol��1mol���Ҳ��м���9mol��ˮ����������������(�������۶����������Ӱ��)��x��һ����Χ�ڱ仯ʱ��������ͨ�����ڷ�Ӧ�����¶ȣ�ʹ���෴Ӧ���ﵽƽ�⣬���Ҹ���ǡ�ô��ڷ�Ӧ��λ��2��
Fe3O4(s)+4H2(g)������м���SO2��O2��SO3�����ʵ����ֱ�Ϊxmol��3.25mol��1mol���Ҳ��м���9mol��ˮ����������������(�������۶����������Ӱ��)��x��һ����Χ�ڱ仯ʱ��������ͨ�����ڷ�Ӧ�����¶ȣ�ʹ���෴Ӧ���ﵽƽ�⣬���Ҹ���ǡ�ô��ڷ�Ӧ��λ��2��![]() ����д���¿հף�
����д���¿հף�

(1)��x=1.5����෴Ӧ����ʼʱ�� ______�������Ӧ�����淴Ӧ�����������![]() ��ʹ��Ӧά����÷�����У���x��ȡֵ��Χ�� ______ ��
��ʹ��Ӧά����÷�����У���x��ȡֵ��Χ�� ______ ��
(2)��X=2������෴Ӧ����ʼʱ�� ______�����Ӧ�����淴Ӧ����������У�ƽ��ʱ�������SO2��ռ���������Ϊ ______ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com