
【题目】下列化合物中阳离子和阴离子电子层结构相同的是( )
A. NaClB. MgF2C. MgCl2D. K2O
科目:高中化学 来源: 题型:
【题目】PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
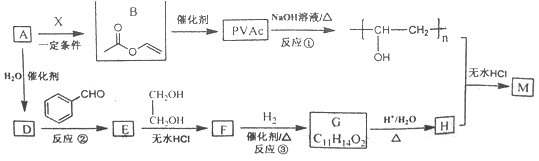
己知:R、R'、R"为H原子或烃基。
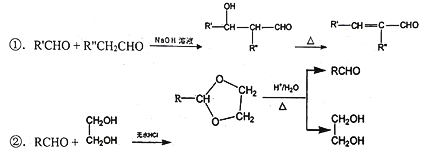
③羟基连在碳碳双键或碳碳三键上不稳定。
(1)已知标准状况下,3.36L气态烃A的质量是3.9g, A—B为加成反应,则X的结构简式为________;B中官能团的名称是_______。
(2)E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是____,在E→F→G→H的转化过程中,乙二醇的作用是______。
(3)反应①的化学方程式为_______。
(4)己知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为____________。
(5)E的同分异构体中含有苯环和甲基,且甲基不与苯环直接相连的同分异构体有_____种。
(6)以甲醇、本乙醛以及上述合成路线中的必要有机试剂为原料合成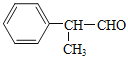 (其他无机试剂任选),请写出合成路线_______。
(其他无机试剂任选),请写出合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:

下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度, 40 min时升高温度
D. 8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:2SO2+O2![]() 2SO3,下列有关说法正确的是
2SO3,下列有关说法正确的是
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当O2的浓度不变时,反应达到平衡状态
C. 当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态
D. 当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是 ( )
A.标准状况下,2.24 L CHCl3含有的分子数为0.1NA
B.0.1 mol CnH2n+2中含有的碳碳单键数为0.1nNA
C.2.8 g乙烯和丙烯的混合气体中所含碳原子为0.2NA
D.1 mol苯乙烯中含有碳碳双键数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A元素在地壳中含量位列第6,A的密度为0.97 g/cm3;B为紫红色固体,锈蚀时变为绿色;C在空气中加热融化但不滴落;D在氧气燃烧,火星四射。根据以上信息回答下列问题:写出对应化学式:
(1)A在室温下与氧气反应生成______,D在空气中锈蚀生成的氧化物为_____。
(2)写出下列化学方程式:
①A在空气中燃烧_______________;
②B长期置于空气中变成绿色物质_________。
(3)将5 g钠铝合金投入200 mL的水中,固体完全溶解,产生4.48 L标准状态下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为______,所得溶液中溶质的物质的量浓度为_____(假设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A由三种元素组成,某兴趣小组进行了如下实验:

已知:气体甲为纯净物且只含两种元素,在标况下体积为672 mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:
(1)A的组成元素为________(用元素符号表示);
(2)写出气体甲与NaOH(aq)反应的离子方程式________;
(3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物试写出相应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟用碱性烂版液(主要成分为[Cu(NH3)4]Cl2和Cu(OH)2)为原料制取摩尔盐,并回收铜单质,设计流程如下:

已知温度超过60℃时,FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式________。
(2)实验中第一步所用硫酸浓度为4 mol/L,不能太小,原因是________。
(3)关于该实验过程的下列说法中正确的是________。
A.所加铁粉应该现用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示

B.溶液A与铁粉反应温度若高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1 mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5-6之间,若pH过高,可用硫酸调节,以抑制Fe2+水解。
(4)为从溶液C得到较纯的摩尔盐,请选择下列合适的操作并排序________。
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净________。
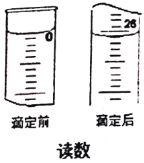
(6)为了测定产品中摩尔盐(M = 392 g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.085 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向10mL.0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液。滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
(已知1g5=0.7)

A. x、y两点c(Ca2+)之比为2000:3 B. Ksp(CaCO3)=5×10-9
C. w点对应的分散系很稳定 D. x、y、z三点中,水的电离程度最大的为x点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com