
【题目】反应mA(g)+nB(g)![]() pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了nmol/L,C的浓度增加了2n/3mol/L,又知,平均反应速率VC=2VB.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,则该反应的化学方程式应为
pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了nmol/L,C的浓度增加了2n/3mol/L,又知,平均反应速率VC=2VB.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,则该反应的化学方程式应为
A. 2A(g)+6B(g)![]() 3C(g)+5D(g)
3C(g)+5D(g)
B. 3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
C. 3A(g)+B(g)![]() 2C(g)+D(g)
2C(g)+D(g)
D. A(g)+3B(g)![]() 3C(g)+3D(g)
3C(g)+3D(g)
【答案】B
【解析】
利用速率之比等于化学计量数之比、浓度变化量之比等于化学计量数之比,确定m、n、p的关系,平衡后,若保持温度不变,给体系加压,平衡不移动,故反应前后气体的物质的量不变,据此确定q,进而确定m、n、p、q关系。
A的浓度减少了nmolL-1,C的浓度增加了2n/3molL-1,则m:p= =3:2,平均反应速率vc=2vB,故v(C):v(B):v(C)=n:p=1:2,故m:n:p=3:1:2,平衡后,若保持温度不变,给体系加压,平衡不移动,故反应前后气体的物质的量不变,即m+n=p+q,
故3+1=2+q,故q=2,所以m:n:p:q=3:1:2:2,故选B。


科目:高中化学 来源: 题型:
【题目】关于分散系,下列叙述中正确的是
A.分散系分为胶体和溶液
B.电泳现象可证明胶体带电荷
C.利用丁达尔效应可以区别溶液与胶体
D.按照分散质和分散剂状态不同(固、液、气),它们之间可有6种组合方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:2SO2+O2![]() 2SO3,下列有关说法正确的是
2SO3,下列有关说法正确的是
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当O2的浓度不变时,反应达到平衡状态
C. 当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态
D. 当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A元素在地壳中含量位列第6,A的密度为0.97 g/cm3;B为紫红色固体,锈蚀时变为绿色;C在空气中加热融化但不滴落;D在氧气燃烧,火星四射。根据以上信息回答下列问题:写出对应化学式:
(1)A在室温下与氧气反应生成______,D在空气中锈蚀生成的氧化物为_____。
(2)写出下列化学方程式:
①A在空气中燃烧_______________;
②B长期置于空气中变成绿色物质_________。
(3)将5 g钠铝合金投入200 mL的水中,固体完全溶解,产生4.48 L标准状态下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为______,所得溶液中溶质的物质的量浓度为_____(假设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A由三种元素组成,某兴趣小组进行了如下实验:

已知:气体甲为纯净物且只含两种元素,在标况下体积为672 mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:
(1)A的组成元素为________(用元素符号表示);
(2)写出气体甲与NaOH(aq)反应的离子方程式________;
(3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物试写出相应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取质量为a g的Fe2O3和CuO的混合固体粉末,进行如下实验:
(1)固体粉末在加热条件下用足量的CO还原,得到金属混合物b g,将生成的CO2气体用足量的澄清石灰水吸收后,产生c g白色沉淀。则a = ________g(用含b、c的代数式表示)。
(2)固体粉末溶于足量盐酸后,加入适量的铁粉,所得溶液中的金属离子只有Fe2+,同时收集到224 mL H2(标准状况下),共用去0.03 mol铁粉。则原混合物中Fe2O3的物质的量是________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟用碱性烂版液(主要成分为[Cu(NH3)4]Cl2和Cu(OH)2)为原料制取摩尔盐,并回收铜单质,设计流程如下:

已知温度超过60℃时,FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式________。
(2)实验中第一步所用硫酸浓度为4 mol/L,不能太小,原因是________。
(3)关于该实验过程的下列说法中正确的是________。
A.所加铁粉应该现用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示

B.溶液A与铁粉反应温度若高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1 mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5-6之间,若pH过高,可用硫酸调节,以抑制Fe2+水解。
(4)为从溶液C得到较纯的摩尔盐,请选择下列合适的操作并排序________。
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净________。
(6)为了测定产品中摩尔盐(M = 392 g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.085 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为________。
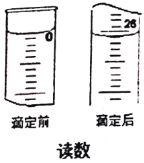
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L 0.1moL某一元酸HR溶液中逐渐加入BOH,若溶液温度和体积保持不变,所得混合溶液的与pH变化的关![]() 、
、![]() 系如图中M或N线所示。下列叙述正确的是
系如图中M或N线所示。下列叙述正确的是
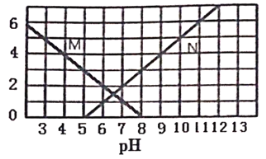
A. M线表示![]() 随pH的变化 B. 若温度升高,两条线均往上平移
随pH的变化 B. 若温度升高,两条线均往上平移
C. BR溶液呈碱性 D. 25℃,0.1 mol/L NaR溶液的pH约为10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com