
【题目】在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g);3Fe(s)+4H2O(g)
2SO3(g);3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为xmol、3.25mol、1mol;右侧中加入9mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处
Fe3O4(s)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为xmol、3.25mol、1mol;右侧中加入9mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处![]() 请填写以下空白:
请填写以下空白:

(1)若x=1.5则左侧反应在起始时向 ______(填“正反应”或“逆反应”)方向进行![]() 欲使反应维持向该方向进行,则x的取值范围是 ______ 。
欲使反应维持向该方向进行,则x的取值范围是 ______ 。
(2)若X=2,则左侧反应在起始时向 ______填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为 ______ 。
【答案】逆反应 1.25<x<1.75 正反应 0.25
【解析】
试题(1)这两个平衡体系的特点是:第一个反应前后气体的总物质的量发生变化,第二个保持不变,故右边永远是9mol气体,同在一个容器中,同温同压,故气体的物质的量之比等于体积之比。故平衡时,左边为6mol气体;当x=1.5时,左边现在总的物质的量为5.75mol<6mol,故向逆反应方向进行;若保持该方向,1.25<x<1.75;
(2)根据上述,反应向正反应方向进行了

平衡总物质的量为6mol,即 2-2y+3.25-y +1+2y= 6mol,解之,得y =0.25mol,2-2y =1.5,二氧化硫的体积分数="1.5/6=25%" ;


科目:高中化学 来源: 题型:
【题目】某实验小组拟用碱性烂版液(主要成分为[Cu(NH3)4]Cl2和Cu(OH)2)为原料制取摩尔盐,并回收铜单质,设计流程如下:

已知温度超过60℃时,FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式________。
(2)实验中第一步所用硫酸浓度为4 mol/L,不能太小,原因是________。
(3)关于该实验过程的下列说法中正确的是________。
A.所加铁粉应该现用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示

B.溶液A与铁粉反应温度若高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1 mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5-6之间,若pH过高,可用硫酸调节,以抑制Fe2+水解。
(4)为从溶液C得到较纯的摩尔盐,请选择下列合适的操作并排序________。
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净________。
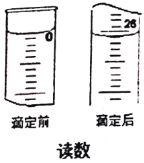
(6)为了测定产品中摩尔盐(M = 392 g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.085 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向10mL.0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液。滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
(已知1g5=0.7)

A. x、y两点c(Ca2+)之比为2000:3 B. Ksp(CaCO3)=5×10-9
C. w点对应的分散系很稳定 D. x、y、z三点中,水的电离程度最大的为x点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。
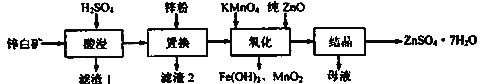
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生氧化还原反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是_______________________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
(5)ZnSO4 ·7H2O可用于配制铁件上镀锌电镀池的电解液,下列说法不正确的是_______
A.配制一定物质的量浓度ZnSO4溶液时必需的玻璃仪器为容量瓶、烧杯、玻璃棒
B.电镀池的阳极为铁件
C.阴极质量增加65g时,理论上导线中通过2mol电子
D.电镀过程中电解质溶液的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型的光化学电源,当光照射光电极时,通入O2和H2S即产生稳定的电流(H2AQ和AQ是两种有机物)。下列说法不正确的是
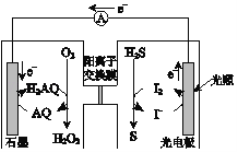
A. 负极的电极反应为2I﹣﹣2e﹣═I2
B. 总反应为 H2S+O2 ![]() H2O2+S
H2O2+S
C. H+通过阳离子交换膜从正极区进入负极区
D. 电源工作时发生了光能、化学能、电能间的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0
B. 反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0
C. 若ΔH > 0,ΔS < 0,化学反应在任何温度下都能自发进行
D. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL 0.5mol/L的氨水中逐滴加入等物质的量浓度的盐酸,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法错误的是

A. 从a点到b点,混合溶液不可能存在:c(Cl-)=c(NH4+)
B. 由水电离的c(H+):b点>c点
C. NH3·H2O的电离程度:b点>a点
D. b点到c点,混合溶液中可能存在:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg / LiFePO4电池的电池反应为xMg2++2LiFePO4![]() xMg+2Li1-xFePO4+2xLi+,其装置示意图如下:
xMg+2Li1-xFePO4+2xLi+,其装置示意图如下:

下列说法正确的是
A. 放电时,Li+被还原
B. 充电时,电能转变为化学能
C. 放电时,电路中每流过2mol电子,有1molMg2+迁移至正极区
D. 充电时,阳极上发生的电极反应为LiFePO4-xe-= Li1-xFePO4 + xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com