
【题目】如图是一种新型的光化学电源,当光照射光电极时,通入O2和H2S即产生稳定的电流(H2AQ和AQ是两种有机物)。下列说法不正确的是
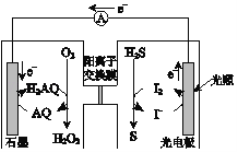
A. 负极的电极反应为2I﹣﹣2e﹣═I2
B. 总反应为 H2S+O2 ![]() H2O2+S
H2O2+S
C. H+通过阳离子交换膜从正极区进入负极区
D. 电源工作时发生了光能、化学能、电能间的转化
科目:高中化学 来源: 题型:
【题目】物质A可发生如图所表示的反应:
写出相应物质的化学式和类别(填在表格内),并依次写出各步反应的化学方程式。
A | B | C | D | E | |
化学式 | Cu | CuCl2 | ____ | ____ | ____ |
类 别 | _____ | _____ | 碱 | 氧化物 | 盐 |

(1)______________________________。
(2)______________________________。
(3)______________________________。
(4)______________________________。
(5)______________________________。
(6)______________________________ 。
(7)______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 容器内压强P:P甲=P丙>2P乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比 k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备纯净的液态无水四氯化锡的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
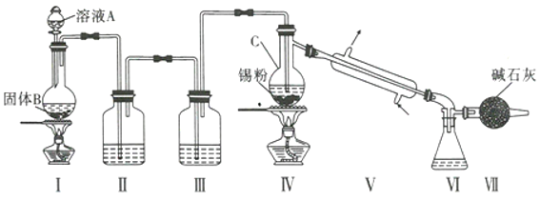
回答下列问题:
(1) Sn在元素周期表中的位罝为____________________________。
(2) Ⅱ、Ⅲ中的试剂分別为_______、__________;Ⅶ的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是_________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g);3Fe(s)+4H2O(g)
2SO3(g);3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为xmol、3.25mol、1mol;右侧中加入9mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处
Fe3O4(s)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为xmol、3.25mol、1mol;右侧中加入9mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处![]() 请填写以下空白:
请填写以下空白:

(1)若x=1.5则左侧反应在起始时向 ______(填“正反应”或“逆反应”)方向进行![]() 欲使反应维持向该方向进行,则x的取值范围是 ______ 。
欲使反应维持向该方向进行,则x的取值范围是 ______ 。
(2)若X=2,则左侧反应在起始时向 ______填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1 mol O2与1 mol N2的总能量比2 mol NO的总能量________(填“高”或“低”)。
②![]() N2(g)+
N2(g)+![]() O2(g)===NO(g)的ΔH=________。
O2(g)===NO(g)的ΔH=________。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值________(选填“增大”“减小”或“不变”)。
2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值________(选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH1。下图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔH1________(选填“>”“=”或“<”)0。
②图中途径(Ⅱ)的条件是_______________,途径(Ⅰ)的反应热________(选填“>”“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
H2(g)+![]() O2(g)===H2O(g) ΔH2
O2(g)===H2O(g) ΔH2
2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(g) ΔH3
ΔH1、ΔH2、ΔH3三者的关系式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。
(实验Ⅰ)向盛有H2O2溶液的试管中,加入过量的K2Cr2O7溶液和硫酸,振荡,溶液立即变为紫红色,此时pH=1.溶液中持续产生气泡,最终溶液变为绿色。
资料:
ⅰ.Cr2(SO4)3溶液呈绿色。
ⅱ.酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2。
ⅲ.CrO5是一种+6价Cr的过氧化物,其结构如图1,CrO5可溶于水,易溶于乙醚得到蓝色溶液。
ⅳ.乙醚是一种无色、不溶于水、密度比水小的有机溶剂,化学性质稳定。
(1)实验Ⅰ中产生的气体是O2,检验的方法是___________。
(2)实验Ⅰ的紫红色溶液中含有CrO5。
①验证紫红色溶液中含有CrO5的操作及现象是_________________。
②生成CrO5的反应不是氧化还原反应,反应的离子方程式是_______________。
(3)对实验Ⅰ中溶液变为绿色和产生O2的原因,作出如下假设:
a.CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。
b.CrO5在酸性条件下氧化了溶液中的H2O2,生成Cr3+和O2。
为验证上述假设,用图2装置进行实验Ⅱ和实验Ⅲ(夹持装置已略,B中石蜡油用于吸收挥发出的乙醚)。实验操作及现象如下:
(实验Ⅱ)
ⅰ.将20mL CrO5的乙醚溶液加入A中的20mLpH=1的稀硫酸中,不断搅拌,乙醚层由蓝色变为无色,水层变为绿色,O2体积为V mL。
ⅱ.步骤ⅰ结束后向A中加入少量K2Cr2O7溶液,轻轻搅拌,静置,乙醚层又显出蓝色。
(实验Ⅲ)
仅将实验Ⅱ中的pH=1的稀硫酸替换为等量的含H2O2的pH=1的稀硫酸,重复实验。现象与实验Ⅱ相同,且O2体积仍为V mL。
①实验Ⅱ步骤ⅰ中消耗的CrO5与生成的O2的物质的量之比为2:3,补全离子方程式:2CrO5+____=2Cr3++3O2↑+_____+_____。
②甲同学认为依据实验Ⅱ和Ⅲ中生成O2的体积相同,无法说明假设b是否成立,其理由是_________。
(4)实验Ⅰ中总反应的离子方程式是__________。
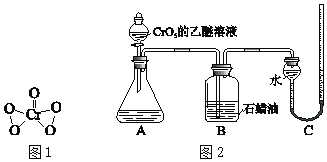
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+ H2O(g) ![]() CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
容器 | 起始物质的量/mol | CH4的平衡 转化率 | |||
CH4 | H2O | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.1 | 0.3 | / |
Ⅲ | 0 | 0.1 | 0.2 | 0.6 | / |
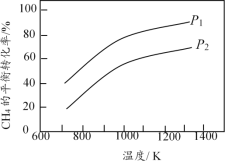
下列说法错误的是
A. 该反应的![]() H>0,图中压强P1>P2
H>0,图中压强P1>P2
B. 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆
C. 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ< 2n(CO)Ⅰ
D. 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比PⅡ∶PⅢ = 4∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com