
【题目】下表是元素周期表的一部分,回答下列有关问题:
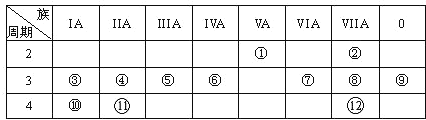
(1)写出下列元素符号:①______ ,⑥______,⑦______。
(2)画出原子的结构示意图:④________________,⑧_________________。
(3)在①~![]() 元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是_______(均填元素名称)。
元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是_______(均填元素名称)。
(4)元素③、⑩、![]() 的氢氧化物碱性由强到弱的顺序________________;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序______________________(均用化学式填空)。
的氢氧化物碱性由强到弱的顺序________________;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序______________________(均用化学式填空)。
【答案】N Si S ![]()
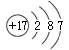 钾 氟 氩 KOH>Ca(OH)2>NaOH SiH4<H2S<HCl
钾 氟 氩 KOH>Ca(OH)2>NaOH SiH4<H2S<HCl
【解析】
根据元素在周期表中的位置确定各种元素,然后利用元素周期律分析解答,对各个问题逐一进行解答。
根据元素在周期表的相对位置可知:①是N,②是F,③是Na,④是Mg,⑤是Al,⑥是Si,⑦是S,⑧是Cl,⑨是Ar,⑩是K,![]() 是Ca,
是Ca,![]() 是Br元素。
是Br元素。
(1)根据上述分析可知:①是N,⑥是Si,⑦是S元素;
(2)④是Mg元素,原子序数是12,原子核外电子排布为2、8、2,其原子结构示意图是:![]() ;
;
⑧是Cl元素,原子序数是17,原子核外电子排布为2、8、7,其原子结构示意图是: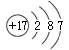 ;
;
(3)同一周期元素,原子序数越大,元素的金属性越弱,非金属性越强;同一主族元素,原子核外电子层数越多,原子越容易失去电子,元素的金属性越强,非金属性越弱,所以在上述元素中,金属性最强的元素是钾元素;非金属性最强的元素是氟元素;0族元素最外层满足2个电子(He)或8个电子的稳定结构,不容易失去电子,也不容易得到电子,化学性质最不活泼,故在上述元素中,最不活泼的元素是氩元素;
(4)由于同一周期元素,原子序数越大,元素的金属性越弱;同一主族元素,原子核外电子层数越多,元素的金属性越强。③是Na,⑩是K,![]() 是Ca,则元素的金属性由强到弱的顺序是:K>Ca>Na,元素的金属性越强,其最高价氧化物对应的水化物的碱性越强,所以这三种元素的氢氧化物的碱性由强到弱的顺序是:KOH>Ca(OH)2>NaOH;
是Ca,则元素的金属性由强到弱的顺序是:K>Ca>Na,元素的金属性越强,其最高价氧化物对应的水化物的碱性越强,所以这三种元素的氢氧化物的碱性由强到弱的顺序是:KOH>Ca(OH)2>NaOH;
由于同一周期的元素,原子序数越小,元素的非金属性越弱。⑥是Si,⑦是S,⑧是Cl,三种元素位于同一周期,则三种元素的非金属性由弱到强的顺序是:Si<S<Cl。元素的非金属性越弱,其相应的氢化物的稳定性就越弱,则这三种元素的氢化物的稳定性由弱到强的顺序是:SiH4<H2S<HCl。


科目:高中化学 来源: 题型:
【题目】LED(LightEmittingDiode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法错误的是( )

A.铜片上发生的反应为2H++2e-=H2↑
B.如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
C.如果将锌片换成铁片,则电路中的电流方向保持不变
D.装置中存在“化学能→电能→光能”的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补铁剂常用于防治缺铁性贫血,其有效成分般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:
(1)能表示能量最低的亚铁离子的电子排布式是__(填标号)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是__,碳原子的杂化方式是__;琥珀酸亚铁中存在配位键,在该配位键中配位原子是__,中心原子是__。
(3)富马酸和马来酸互为顺反异构体,其电离常数如下表:
物质名称 | Ka1 | Ka2 |
富马酸( | 7.94×10-4 | 2.51×10-5 |
马来酸( | 1.23×10-2 | 4.68×10-7 |
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:__。
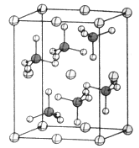
(4)β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a=870pm、b=680pm、c=479pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有__种空间取向,晶胞体内硫酸根离子的个数是__,铁原子周围最近的氧原子的个数为__;设阿伏加德罗常数的值为NA,则该晶体的密度是__g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语使用正确的是:( )
A.硫原子的原子结构示意图:![]()
B.NH3的电子式:![]()
C.原子核内有8个中子的氧原子:![]()
D.CO2的结构式:O—C—O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:A.O2和O3(臭氧);B.![]() 和
和![]() ;
;
C.CH3CH2CH2CH3和![]() ; D.
; D. 和
和 ;
;
E.甲烷和戊烷; F.CH3COOCH3与 CH3CH2COOH;
G.金刚石和石墨; H.液氯与氯气。
(1)_____组两物质互为同位素。
(2)_____组两物质互为同素异形体。
(3)_____组两物质属于同系物。
(4)_____组两组物质互为同分异构体。
(5)_____组中的物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下,A为一元羧酸,10.2g A与足量NaHCO3溶液反应生成2.24L CO2(标准状况),A的分子式为
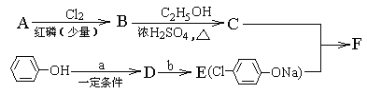
A. C2H4O2B. C3H6O2C. C4H8O2D. C5H10O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1) D元素在周期表中的位置是___________,乙物质的电子式是___________。
(2) A、B、C、D、E五种元素的原子半径由小到大的顺序是_________(用元素符号填写)。
(3) E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是:____________________________。
(4)简述比较D与E金属性强弱的实验方法:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有 Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是

A. 若原溶液中不存在 Na+,则 c(Cl-)<0.1molL﹣1
B. 原溶液可能存在 Cl- 和 Na+
C. 原溶液中 c(CO32-)是 0.01molL﹣1
D. 原溶液一定存在 CO32-和SO42-,一定不存在 Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1mol/LH2R溶液中滴加0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa=-lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。下列有关说法不正确的是
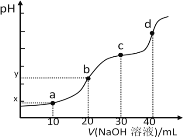
A.溶液的导电性:点a弱于点b
B.离子浓度c(R2-):点c大于点d
C.H2R+R2-=2HR-平衡常数>105,反应趋于完全
D.点b时,y<7且![]() <1
<1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com