
【题目】如图为实验室制备乙炔并进行性质验证的装置(夹持仪器己略去)。
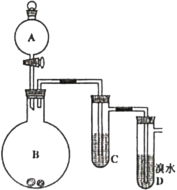
(1)实验室制备乙炔的方程式为___;
(2)仪器A的名称为___,为防止气体生成的速率过快,由A滴入B的试剂为___;
(3)装置C可选用的试剂为___(写出一种即可),其作用为___;
(4)反应开始后,D中的现象为___,所发生反应的反应类型为___;
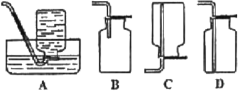
(5)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___。
【答案】CaC2+2H2O→Ca(OH)2+C2H2↑ 分液漏斗 饱和食盐水 NaOH溶液(或CuSO4溶液) 除去气体中的杂质 溴水褪色 加成反应 A
【解析】
碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔,为减缓反应,可用饱和食盐水代替水;得到的乙炔气体中混有H2S等还原性有毒气体,可以用NaOH溶液或硫酸铜溶液来除去;乙炔含有不饱和键,能够与溴水发生加成反应,使溴水褪色;乙炔难溶于水,可以用排水法收集。
(1)碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔,配平即可,方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)仪器A为分液漏斗,乙炔与水反应剧烈,为减缓反应,可用饱和食盐水,故答案为:分液漏斗;饱和食盐水;
(3)电石中往往混有CaS等杂质,与水反应会产生H2S等还原性有毒气体,硫化氢能与NaOH溶液或硫酸铜溶液反应,可以用NaOH溶液或硫酸铜溶液除去,故答案为:NaOH溶液(或CuSO4溶液);除去气体中的杂质;
(4)乙炔能够和溴水发生加成反应,方程式为:CH≡CH+2Br2→CHBr2CHBr2,D中的现象为溴水褪色;故答案为:溴水褪色;加成反应;
(5)乙炔难溶于水选择A收集,在装置C之后连接收集装置,最适合用于收集A排水法收集,气体纯度高,故答案为:A。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
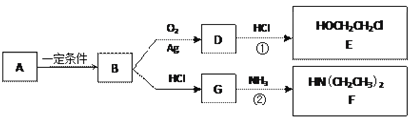
(1)B的结构简式是_________________
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3→ F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示): ____________________________________
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:![]() )
)
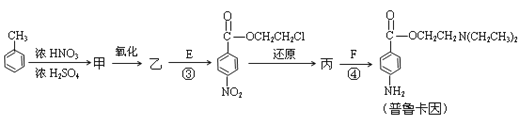
(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是___________________________________
(6)丙中官能团的名称是_______________________________________。
(7)普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
② 戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是__________________________________________。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
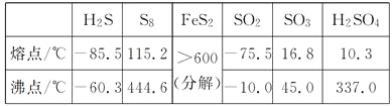
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。
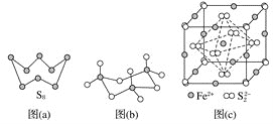
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题。
I.请写出下列物质所含官能团的名称:
(1)CH3CH2CH2OH;___(2)CH2=CHCH2CH3;___
II.请写出下列物质所含官能团的结构简式:
(3)CH3CH2COOH;___(4)CH3CH2CH2Br;___
III.请按照系统命名法为下列物质命名:
(5)![]() ;___
;___
(6)![]() 。___
。___
IV.请按照要求画出相应的同分异构体:
(7)分子式为C5H10O的醛共有___种;在这些醛中,醛A的核磁共振氢谱中的信号数量最少(即峰数最少),A的结构简式是___。
(8)不考虑顺反异构的情况下,链状卤代烃C4H7Cl的同分异构体共有___种;若考虑顺反异构,链状卤代烃C4H7Cl的同分异构体共有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组从植物香料中分离出一种罕见的醇(醇A),其结构简式如下。
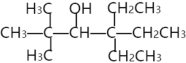
(1)根据课内所学知识,该醇可发生的反应包括:___(填字母序号)
A.与金属Na反应 B.与CuO反应
C.与浓盐酸反应 D.消去反应
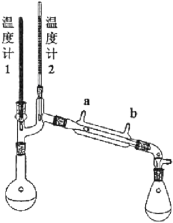
I.该课题组设计了以醇A为原料制备某物质的合成路线。合成反应的第一步。拟使醇A与浓氢溴酸(质量分数47.6%)在90℃下充分反应,制备中间产物B。实验装置如图所示(夹持及加热仪器略去)。
已知:①HBr溶液受热时,HBr能否蒸发受到体系汇总含水量的影响。具体情况如下表。
| <47.6% | 47.6% | >47.6% |
先蒸发的物质 | 水先蒸发,直至比值升至47.6% | HBr与水按该比例一起蒸发、液化沸点124.3℃ | HBr先蒸发,直至比值降至47.6% |
②醇A、中间产物B的沸点均超过200℃。
(2)温度计1拟用于监控反应温度,温度计2拟用于监控实验中离开烧瓶的物质的沸点。两个温度计中,水银球位置错误的是___(填“温度计1”或“温度计2”)其水银球应___;
(3)实验时,冷凝水应从冷凝管的___(填“a口”或“b口”)流入。
II.将温度计位置调节好后,课题组成员依次进行如下操作:
①检验气密性,装入沸石;
②加入18.6g醇A(0.1mol)、17.0g47.6%氢溴酸(含8.1gHBr、0.1mol);
③开始加热,逐渐升温至反应温度。
(4)反应开始后,当温度计2的示数上升至39℃时,冷凝管末端持续有液体流出。反应结束时,共收集到无色液体7.0g。经检测,该液体为纯净物,标记为产物C。取0.7gC在氧气中充分燃烧,共收集到2.2gCO2、0.9gH2O。另取少量C进行质谱试验,结果如图所示。
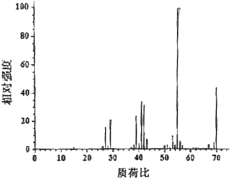
根据上述实验结果,C的分子式为___;
(5)取少量产物C进行核磁共振氢谱试验,共有三个信号峰。三个信号峰的面积之比为3:6:1。综合上述实验结果,C的结构简式为___;
(6)反应结束后,圆底烧瓶内液体分为两层。可用___方法(填实验操作名称)将两液体分离;
(7)后续检验证实,两液体均较纯净,其中所含杂质均可忽略。上层液体质量为10.7g。取下层液体进行核磁共振氢谱实验,共有两个信号峰。峰的面积之比为3:2。综合以上信息,本实验的实际总反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学知识填空:
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g)= CH4(g)+C2H2(g)+H2(g) ΔH1=+156.6 kJ·mol![]()
②C3H6(g)= CH4(g)+C2H2(g) ΔH2=+32.4 kJ·mol![]()
则相同条件下,反应C3H8(g)=== C3H6(g)+H2(g)的ΔH=__________kJ·mol![]() 。
。
(2)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为C(s)+H2O(g) ![]() CO(g)+H2(g)。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为
CO(g)+H2(g)。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为
C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol![]()
H2(g)+![]() O2(g)===H2O(g) ΔH2=-242.0 kJ·mol
O2(g)===H2O(g) ΔH2=-242.0 kJ·mol![]()
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol![]()
写出C(s)与水蒸气反应生成CO和H2的热化学方程式: ______________________。
(3)3mol甲烷燃烧时,生成液态水和二氧化碳,同时放出2 670.9kJ的热量,写出甲烷燃烧热的热化学方程式_________________________________________________
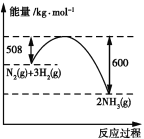
(4)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为____________。
(5)已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol![]() Cl—Cl 的键能为247 kJ·mol
Cl—Cl 的键能为247 kJ·mol![]() ,H—H的键能为436kJ·mol
,H—H的键能为436kJ·mol![]() 则H—Cl的键能为______________kJ·mol
则H—Cl的键能为______________kJ·mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
下列说法正确的是
A. 增加高炉的高度可以有效降低炼铁尾气中CO的含量
B. 由表中数据可判断该反应:反应物的总能量>生成物的总能量
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO表示该反应的平均速率为![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com