
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。 如果分别用相同物质的量的这些物质氧化足量的KI,得到I2最多的是
A. Fe3+ B. MnO4- C. Cl2 D. HNO3
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中Ca2+、Mg2+、SO![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A. ②④⑤①③ B. ④②⑤①③ C. ②⑤④①③ D. ⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置(Ⅱ)的主要缺点是___________________________________,如果选用此装置来完成实验,则必须采取的改进措施是:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
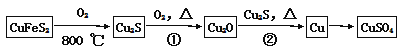
(1)基态硫原子的外围电子排布式为 ,硫元素与氧元素相比,第一电离能较大的元素是 (填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是 ,其立体结构是 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解,得到深蓝色透明溶液,写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
沉淀溶解,得到深蓝色透明溶液,写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为 ;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为 pm(用含d和NA的式子表示)。
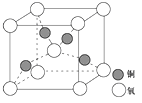
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg![]() MgCl2+2Rb(g),下列说法正确的是( )
MgCl2+2Rb(g),下列说法正确的是( )
A.镁的金属活动性比铷强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2的热稳定性比RbCl弱
D.Rb单质比RbCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同状况下的12C18O和14N2两种气体,下列说法正确的是
A. 若分子数相等,则体积相等 B. 若原子数相等,则中子数相等
C. 若质量相等,则质子数相等 D. 若体积相等,则质量数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用锌与稀硫酸反应制取H2,欲使产生H2的速率加快,下列措施可行的是( )
A.加水稀释B.加少量NaOH溶液C.降低温度D.锌片改为锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断不正确的是( )
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42-
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl-
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100 mL产生的气体A为44.8 mL(标况)则X中c(Fe2+)=0.06 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能含有K+、NH4+、Mg2+、Ca2+、Fe3+、Cl-、CO32-、SO42-中的几种离子,将该固体溶解,取l00.00mL该溶液进行如下实验(气体体积为标准状况体积):

下列说法正确的是
A. 该固体中一定不含Mg2+、Fe3+、Ca2+、Cl- B. 该固体中一定含有SO42-、CO32-、Cl-
C. 根据以上实验,无法确定该固体中有K+ D. 该固体可能是(NH4)2CO3和K2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com