
【题目】目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
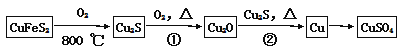
(1)基态硫原子的外围电子排布式为 ,硫元素与氧元素相比,第一电离能较大的元素是 (填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是 ,其立体结构是 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解,得到深蓝色透明溶液,写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
沉淀溶解,得到深蓝色透明溶液,写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
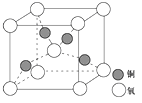
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为 ;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为 pm(用含d和NA的式子表示)。
【答案】(1) 1s22s22p63s23p4 ;O;(2)sp2;V型;
(3)Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;共价键、配位键;
(4)面心立方最密堆积;![]()
![]() ×1010。
×1010。
【解析】试题分析:(1)S位于第三周期ⅥB族,是16号元素,基态硫原子的外围电子排布式为1s22s22p63s23p4;同主族元素第一电离能自上而下逐渐减小,所以第一电离能较大的是氧;故答案为:1s22s22p63s23p4;O;
(2)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+![]() (6-2×2)=3,所以S原子采用sp2杂化,由于含有一个孤电子对,其空间构型是V型;故答案为:sp2;V型;
(6-2×2)=3,所以S原子采用sp2杂化,由于含有一个孤电子对,其空间构型是V型;故答案为:sp2;V型;
(3)硫酸铜溶液与氨水生成氢氧化铜蓝色沉淀,氢氧化铜溶于过量的氨水,形成[Cu(NH3)4]2+离子,蓝色沉淀溶于氨水的离子方程式为Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O,深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有共价键、配位键,故答案为:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;共价键、配位键;
(4)铜晶体中铜原子堆积模型为面心立方最密堆积,在铜的某种氧化物晶胞中,O原子在晶胞的顶点和体心,故O原子数=![]() ×8+1=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,根据密度计算公式ρ=
×8+1=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,根据密度计算公式ρ=![]() 可知,体积V=
可知,体积V=![]() =
=![]() cm3,所以晶胞的边长为
cm3,所以晶胞的边长为![]() cm,根据晶胞的结构图可知,晶胞中铜原子与氧原子之间的距离晶胞边长的
cm,根据晶胞的结构图可知,晶胞中铜原子与氧原子之间的距离晶胞边长的![]() ,所以该晶胞中铜原子与氧原子之间的距离为
,所以该晶胞中铜原子与氧原子之间的距离为![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010pm,故答案为:面心立方最密堆积;
×1010pm,故答案为:面心立方最密堆积;![]() ×
×![]() ×1010
×1010


科目:高中化学 来源: 题型:
【题目】镁、铜等金属离子是人体内多种酶的辅因子。
(1)Cu位于元素周期表第四周期,铜原子核外电子有____种不同的运动状态,Cu+的核外电子排布式为________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴、阳离子个数比为______。

(3)Mg是第三周期元素,该周期部分元素氟化物的熔点下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天要补充60mg的维生素C。下列物质含有丰富维生素C的是____________(填字母)。
A.牛肉 B.辣椒 C.鸡蛋
②青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量元素
是_________( 填字母)
A.碘 B.铁 C.钙
③蛋白质是人体必需的营养物质,它在人体内最终分解为___________(填字母)。
A.葡萄糖 B.氨基酸 C.脂肪酸
(2) 材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是 __________(填字母)。
A.酒精 B.蔗糖 C.甲醛
②玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为_________________________________________________________________。
(3) 保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg ![]() MgCl2+2Rb(g),下列说法正确的是
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,密闭筒形容器中,有活塞位于距全长一端1/5处,左边为空气,右边为H2、O2混合气体,标准状况下,若将H2、O2混合气体点燃引爆,活塞先左弹,恢复到原来温度后,活塞右滑停留在筒的中央,则原来H2、O2的物质的量比可能为 ( )
空气 | H2、O2的混合气 |
A. 7:1 B. 1:1 C. 1:3 D. 4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。 如果分别用相同物质的量的这些物质氧化足量的KI,得到I2最多的是
A. Fe3+ B. MnO4- C. Cl2 D. HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法,不正确的是( )
A. 过氧化钠可用于潜水艇的氧气来源 B. 氯气可用于制农药 C. 纯碱可用于治疗胃酸过多 D. 钠可用于冶炼金属钛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法不正确的是
A. 聚氯乙烯是无毒高分子化合物,属于纯净物
B. 废弃油脂回收后,可以用来制肥皂和甘油
C. 油脂既能提供能量又能促进人体对某些维生素的吸收
D. Fe2O3可用来制作油漆和涂料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com