
����Ŀ��Ī������������������Һ�ⶨ±���Ӻ����ij����ζ�����ijʵ����ȤС�齫��ˮFeCl3���ȱ���Ϸ�����Ӧ��2FeCl3 +C6H5Cl![]() 2FeCl2 +C6H4Cl2+HC1���������ɵ�HCl��ˮ���գ�����Ī���������ˮFeCl3��ת���ʣ�ͬʱ�õ����õĻ�ԭ��FeCl2��������ͼװ�ã�
2FeCl2 +C6H4Cl2+HC1���������ɵ�HCl��ˮ���գ�����Ī���������ˮFeCl3��ת���ʣ�ͬʱ�õ����õĻ�ԭ��FeCl2��������ͼװ�ã�
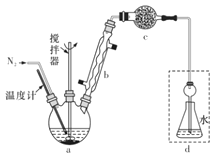
��������ƿ�з���162.5g��ˮFeCl3��225 g�ȱ������Ʒ�Ӧ�¶���130���¼���3 h����ȴ�����ˣ�ϴ�ӡ�����õ��ֲ�Ʒ���й����������
C6H5Cl | C6H4Cl2 | AgCl | Ag2CrO4 | |
��ɫ | �� | �� | ��ɫ | ש��ɫ |
�ܶȻ� | �� | �� | 1.56��10-10 | 9��10-12 |
�۵�/�� | -45 | 53 | �� | �� |
�е�/�� | 132 | 173 | �� | �� |
�ش��������⣺
(1)����c��������_______��ʢװ���Լ�������_______________(����ĸ����)��
A.��ʯ�� B��Ũ���� C.��ˮ�Ȼ��� D.������������
(2)���и�װ��(ʢ������ˮ)�ܴ���ͼ�����߿��ڲ��ֵ���______(����ĸ����)��
e. 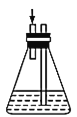 f.
f.  g.
g.  h.
h. 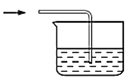
(3)��δ���Һ�л��չ������ȱ���__________��
(4)����ƿ�ڵ���Һϡ����1 000 mL������ȡ��10. 00 mL���μӼ���K2CrO4 ��ָʾ������0. 200 0 mol/L AgNO3��Һ���еζ������ﵽ�յ�ʱƽ������22. 50 mL AgNO3��Һ��
�ٵζ��յ��������________��ʹ����ɫ�ζ��ܽ��еζ���Ŀ����_________��
����ˮFeCl3��ת������=_______
�������ζ����ʱ�����ζ��ܼ��촦�������ݻᵼ�²ⶨ���ƫ________(����������������)��
���𰸡������ C eg ���÷ֲ㣬ȡ�²���Һ�������ռ�132![]() ����� ש��ɫ�������Ұ���Ӳ��� ��ֹAgNO3����ֽ�
����� ש��ɫ�������Ұ���Ӳ��� ��ֹAgNO3����ֽ� ![]() ��
��
��������
������ƿ�з�����ˮFeCl3���ȱ�����130���£�����2FeCl3 +C6H5Cl![]() 2FeCl2 +C6H4Cl2+HCl������Ӧ������ͨN2�������������������ȷ����Ӧ���ɵ�HCl����ȫ���գ������c��ʢװ���Լ�������HCl������ˮ������HCl��������ˮ�������Ȼ���������Ҫ��ֹ������
2FeCl2 +C6H4Cl2+HCl������Ӧ������ͨN2�������������������ȷ����Ӧ���ɵ�HCl����ȫ���գ������c��ʢװ���Լ�������HCl������ˮ������HCl��������ˮ�������Ȼ���������Ҫ��ֹ������
��1������c������Ϊ����ܣ�ʢװ���Լ�������HCl������ˮ������������������ã��ɷŹ�̬�����Ը��������ʯ�Һ�̬��������Ϊ���ԣ�Ũ����ΪҺ̬������ѡ����ˮ�Ȼ��ƣ�ѡC���ʴ�Ϊ������ܣ�C��
��2���������Ȼ����ֹ���������ã�hװ��������f���ܳ���������壬ѡeg���ʴ�Ϊ��eg��
��3���ȱ��ķе�Ϊ132![]() ������Һ�л��չ����ȱ��IJ����ǣ����÷ֲ㣬ȡ�²���Һ�������ռ�132
������Һ�л��չ����ȱ��IJ����ǣ����÷ֲ㣬ȡ�²���Һ�������ռ�132![]() ����֣��ʴ�Ϊ�����÷ֲ㣬ȡ�²���Һ�������ռ�132
����֣��ʴ�Ϊ�����÷ֲ㣬ȡ�²���Һ�������ռ�132![]() ����֣�
����֣�
��4����ָʾ����������ָʾ��������ǡ�ó�����ȫ�������������ȳ�����������ȫ���ٵ�����������Һ������һ����ɫ��ͬ�ij�����ָʾ�����յ㣬������֪ѡ����������ζ��յ��ָʾ�����������һ����Һ�γ�ש��ɫ�����Ұ���Ӳ��䣬˵����Ӧ��ȫ��
AgNO3�����ֽ⣬ʹ����ɫ�ζ��ܽ��еζ���Ŀ�ķ�ֹAgNO3����ֽ⣻�ʴ�Ϊ��ש��ɫ�������Ұ���Ӳ��䣻��ֹAgNO3����ֽ⣻
����Ϸ�Ӧ������ϵ�������غ�õ���
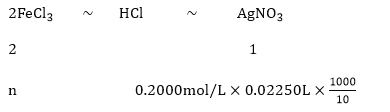
���n=0.90mol��
��������ƿ�з���162.5g��ˮFeCl3���ʵ���Ϊ��![]() ����=
����=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
���ζ����ʱ���ζ��ܼ��촦�������ݻᵼ������Ҫ0.2000molL1AgNO3��Һ���������ƫС��ʹ�ⶨ���ƫ�ͣ��ʴ�Ϊ���͡�


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ɷ��Ǹ��л�ѧѧϰ���õķ���֮һ��ij��ѧ�о���ѧϰС����ѧϰ�ˡ���ѧ��Ӧԭ���������������µĹ����ܽ������ȷ����
�����ѽ�����ѧƽ���ij���淴Ӧ�����ı�����ʹ��ѧƽ��������Ӧ�����ƶ�ʱ��������IJ���һ������
�������£�pH��3�Ĵ�����Һ��pH��11��NaOH��Һ�������Ϻ��γ���Һa����Ũ�ȵ�������NaOH��Һ�������Ϻ��γ���Һb��ˮ�ĵ���̶�a��b��
�������£�AgCl��ͬ���ʵ���Ũ�ȵİ�ˮ��NaCl��Һ�е��ܽ�ȱȽϣ�ǰ�ߴ�
����������CO2ͨ��0.1 mol/LNa2CO3��Һ������Һǡ�ó����ԣ�����Һ��(��������Һ����仯) 2c(CO32-)+ c(HCO3��)= 0.1 mol/L
�������£���֪�������ƽ�ⳣ��ΪKa�������ˮ��ƽ�ⳣ��ΪKh��ˮ�����ӻ�ΪKw�����У�Ka��Kh��Kw
A.�٢ڢܢ�B.�ڢܢ�C.�ڢ�D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�����ڹ�ҵ��������������;��ij�����Ի�ͭ��(��Ҫ�ɷ�ΪCu2S��������Fe2O3��SiO2������)Ϊԭ���Ʊ�������ˮ�ļ�ʽ̼��ͭ��������ͼ��

(1)�ӿ�����ȡ�����ʳ�����ͭ������⣬���ɲ�ȡ�Ĵ�ʩ��_________ (��дһ��)���о��������ȳ����ٽ�ȡ����ȡ�������Ա����������ԭ����________��
(2)����I�е���Ҫ�ɷ���MnO2��S��SiO2����д������ȡ����Ӧ������S�Ļ�ѧ����ʽ��________��
(3)��������������ʱ������Լ�A����____________��Ϊ���ʣ�����A����Һ��pH��Ϊ5������Һ��Fe3+ ��Ũ��Ϊ______mol/L��{Ksp[Fe(OH)3]=4.0��10- 38}
(4)д��������"(��Mn2+ )�����з�Ӧ�����ӷ���ʽ��______��
(5)���ϰ���ʱ�������˵IJ���������__________��
(6)��ҺII�������ᾧ�õ�������Ҫ��________(д��ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״������ǿ��������õ�һ������Դ����֪��
��2H2(g)+O2(g)=2H2O(l) ��H1=-571.8 kJ/mol��
��CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ��H2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ��H2=-192.9 kJ/mol
(1)��ʾ�״���ȫȼ���ȵĵ��Ȼ�ѧ����ʽΪ________________��
(2)��Ӧ���е������仯��ͼ��ʾ������H2=__________��(��E1��E2�����ʽ�ӱ�ʾ)��

(3)��̼����(��Ҫָ����CO2�ڽ������������ŷ��о�����Ҫ�����á�ĿǰNH3��(NH4)2CO3�Ѿ���������ҵ��̼��,������CO2�ɷ������·�Ӧ��
��Ӧ��2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ��H1
(NH4)2CO3(aq) ��H1
��Ӧ��NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ��H2
NH4HCO3(aq) ��H2
��Ӧ��: (NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ��H3
2NH4HCO3(aq) ��H3
����H3����H1 ����H2��֮��Ĺ�ϵΪ��H3 =_________��
(4)��1mol��̬������ij�ֹ��ۼ���Ҫ���յ������м��ܡ��ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̡��ڻ�ѧ��Ӧ�����У���ѧ����Ҫ�����������γɻ�ѧ���ֻ��ͷ�������
��ѧ�� | H��H | N��H | N��N |
����/kJ/mol | 436 | 391 | 945 |
��֪��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H=akJ/mol���Ը��ݱ������м������ݹ���a��ֵ______��(ע����+����������)��
2NH3(g) ��H=akJ/mol���Ը��ݱ������м������ݹ���a��ֵ______��(ע����+����������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ��H = ��Q1
2H2(g) + O2(g) = 2H2O(g) ��H = ��Q2�� 2H2(g) + O2(g) = 2H2O(l) ��H = ��Q3
�����£�ȡ��������������Ϊ4:1�Ļ������11.2L�����ۺϳɱ�״��������ȫȼ�պ�ָ������£���ų�������Ϊ�� ��
A.0.4Q1 + 0.05Q2B.0.4Q1 + 0.05Q3C.0.4Q1 + 0.1Q2D.0.4Q1 + 0.1Q3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾij���淴Ӧ��ʹ�ú�δʹ�ô���ʱ����Ӧ���̺������Ķ�Ӧ��ϵ������˵��һ����ȷ����
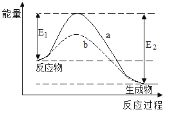
A.�÷�ӦΪ���ȷ�Ӧ
B.a��b��ȣ�a�ķ�Ӧ���ʸ���
C.a��b��ȣ���Ӧ��ƽ�ⳣ��һ����ͬ
D.E2����E1��˵��������������ȷ�Ӧ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����ʵ������ƽ���ƶ�ԭ�����͵���
A. pH=11�İ�ˮϡ��10������ҺpH��10
B. ���Ȼ�����Һ�������ɲ����գ����յ�����������
C. ��2HI��g��![]() H2��g��+I2��g������С���������������ɫ����
H2��g��+I2��g������С���������������ɫ����
D. ˮ���к���CaSO4��������Na2CO3��Һ���ݴ���������������ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����������ʵ��װ��̽������ʽԭ��صĹ���ԭ��������ʵ�鲽�����λش��������⣺

��1��ͭΪ___���������е�������Ϊ___(��a��b��ʾ)��
��2����װ����ͭ�缫����������3.2g��������ת�Ƶĵ�����ĿΪ___��(����NA��ʾ�����ӵ���������NA����ʾ)
��3��װ�õ������г�������֬�⣬��Ҫ����KCl�ı�����Һ����ع���ʱ���������е�K����Cl�����ƶ�����ı�����ȷ����___��
A�������е�K�����Ҳ��ձ��ƶ���Cl��������ձ��ƶ�
B�������е�K��������ձ��ƶ���Cl�����Ҳ��ձ��ƶ�
C�������е�K����Cl�����������ƶ�
��4��������Ӧ2Fe3+ +Cu=2Fe2+ +Cu2+��Ƴ�ԭ��أ���������Ӧ��___��
��5�����һ���绯ѧװ�ã�ʵ�������Ӧ��Cu+H2SO4=CuSO4+H2�����������淽���ڻ�������绯ѧװ��ͼ��___

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c��d���ֶ�����Ԫ�������ڱ��е�λ����ͼ��ʾ��a��b�ֱ�λ�����ڱ��ĵ�2�к͵�13�У�����������ȷ�ģ� ��

A.���Ӱ뾶b>d
B.b���Ժ�ǿ����Һ������Ӧ
C.c������⻯��Ŀռ�ṹΪ������
D.a������������Ӧˮ������ǿ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com