
| X | ||
| Z |
| A. | 原子半径:r(Y)>r (Z)>r (W) | |
| B. | Y、Z、W的简单离子的电子层结构相同 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z 的简单气态氢化物的热稳定性比W 的强 |
分析 周期主族元素X、Y、Z、W 的原子序数依次增大,根据元素在周期表中的位置知,X位于第二周期,Z位于第三周期,X的最低负价绝对值与其原子最外层电子数相等,则X是C元素,则Z是S元素,W是短周期主族元素且原子序数大于S,所以W是Cl元素,X、Y、Z原子序数之和是W的2倍,则Y是Mg元素,再结合元素周期律、物质结构分析解答.
解答 解:A.原子的电子层数越多其原子半径越大,同一周期元素,其原子半径随着原子序数的增大而减小,所以原子半径:r(Y)>r(Z)>r(W),故A正确;
B.Y离子有2个电子层、Z和W离子有3个电子层,所以Y和Z、W的简单离子的电子层结构不同,故B错误;
C.CCl4与MgCl2中化学键分别为共价键和离子键,所以其化学键类型不同,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,W的非金属性大于Z,所以元素Z的简单气态氢化物的热稳定性比W的简单气态氢化物弱,故D错误.
故选A.
点评 本题考查了元素周期表和元素周期律的综合应用,为高考常见题型,明确元素周期表结构及原子结构是解本题关键,再结合元素周期律、物质的构成微粒及微粒间的作用力分析解答,熟记元素周期律内涵,题目难度不大.


科目:高中化学 来源: 题型:实验题
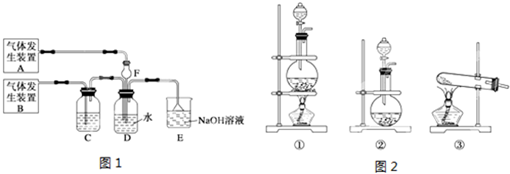
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的ECC水泥是最新研制出来的,其最明显的特征是可以在弯曲状态下承受相当大的压力,因为材料里面有特殊制成的聚合体纤维微粒,所以ECC水泥可以在承受较大压力的状态下弯曲而不破裂.则聚合体纤维微粒在该材料中的作用是( )
如图所示的ECC水泥是最新研制出来的,其最明显的特征是可以在弯曲状态下承受相当大的压力,因为材料里面有特殊制成的聚合体纤维微粒,所以ECC水泥可以在承受较大压力的状态下弯曲而不破裂.则聚合体纤维微粒在该材料中的作用是( )| A. | 做粘合剂,起粘合作用 | B. | 做增强体,起骨架作用 | ||
| C. | 做导电体,起导电作用 | D. | 做原子晶体,起耐热作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: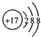 | |
| B. | 聚丙烯的结构简式: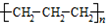 | |
| C. | 三氟化氮的电子式: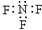 | |
| D. | 熔融硫酸氢钾电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$ K++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
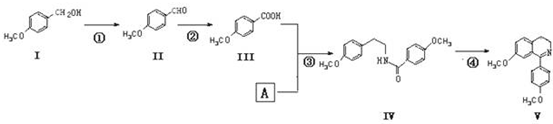
 .
.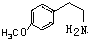 .
.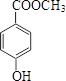 (或
(或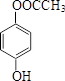 、
、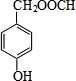 ).
).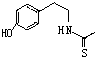 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为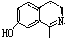 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO 和CO2 | D. | NO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 颜色褪成无色 | B. | 浅绿色逐渐加深 | C. | 没有变化 | D. | 变为棕黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
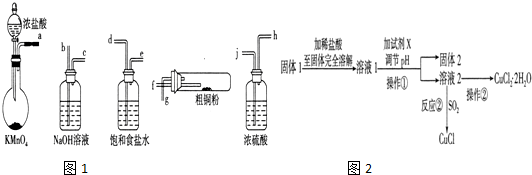
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com