
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr3+基态核外电子排布式为___________。
(2)AlCl3可作下列反应的催化剂。

①1mol对甲基苯乙酮分子中含有的σ键数目为__________。
②CH3COOH与H2O可以任意比例互溶的原因是_____________。
(3)用价层电子对互斥理论解释![]() 的键角大于
的键角大于![]() 的原因是__________。
的原因是__________。
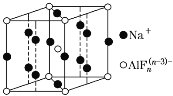
(4)某遮光剂的晶胞如图所示,由晶胞可知n=________。
【答案】1s22s22p63s23p63d3或[Ar]3d3 20NA CH3COOH与H2O形成分子间氢键,两者都为极性分子,根据相似相溶原理可得 两种离子的中心硫原子均为sp3杂化,![]() 中没有孤对电子,
中没有孤对电子,![]() 有一对孤对电子,孤对电子对成键电子对有排斥作用,因此键角更小 6
有一对孤对电子,孤对电子对成键电子对有排斥作用,因此键角更小 6
【解析】
根据基态原子的电子排布式确定其离子的电子排布情况;根据分子结构确定分子中共价键的的数目;根据氢键对物质性质的影响分析乙酸和水互溶的原因;根据价层电子对互斥理论分析比较键角的大小关系;根据均摊法确定晶体的化学式。
(1)铬是24号元素,其基态原子的电子排布式为1s22s22p63s23p63d54s1,所以,Cr3+基态核外电子排布式为1s22s22p63s23p63d3或[Ar]3d3。
(2)①对甲基苯乙酮的结构简式为![]() ,其分子中有9个碳碳σ键、10个C-H键、1个C=O键,单键全部是σ键,双键中有一个是σ键,所以,1mol对甲基苯乙酮分子中含有的σ键数目为20NA。
,其分子中有9个碳碳σ键、10个C-H键、1个C=O键,单键全部是σ键,双键中有一个是σ键,所以,1mol对甲基苯乙酮分子中含有的σ键数目为20NA。
②CH3COOH与H2O可以任意比例互溶的主要原因是CH3COOH与H2O可以形成分子间氢键,次要原因是两者都是极性分子。
(3) ![]() 和
和![]() 的中心原子均为S原子,其价层电子对数均为4,但是前者没有孤对电子,后者有一对孤对电子,故根据价层电子对互斥理论可知,
的中心原子均为S原子,其价层电子对数均为4,但是前者没有孤对电子,后者有一对孤对电子,故根据价层电子对互斥理论可知,![]() 的键角大于
的键角大于![]() 的原因是:两种离子的中心硫原子均为sp3杂化,
的原因是:两种离子的中心硫原子均为sp3杂化,![]() 中没有孤对电子,
中没有孤对电子,![]() 有一对孤对电子,孤对电子对成键电子对有排斥作用,因此
有一对孤对电子,孤对电子对成键电子对有排斥作用,因此![]() 键角更小。
键角更小。
(4)由晶胞结构可知, ![]() 位于晶胞的顶点和体心,故该晶胞中占有2个
位于晶胞的顶点和体心,故该晶胞中占有2个![]() ;Na+在棱上和面上,该晶胞平均占有Na+的数目为
;Na+在棱上和面上,该晶胞平均占有Na+的数目为![]() ,阳离子与阴离子的个数比为3:1,所以该晶体的化学式为Na3AlFn,根据电荷守恒可知,n-3=3,所以,n=6。
,阳离子与阴离子的个数比为3:1,所以该晶体的化学式为Na3AlFn,根据电荷守恒可知,n-3=3,所以,n=6。


科目:高中化学 来源: 题型:
【题目】常温下,用0.01molL-1的NaOH溶液滴定20mL同浓度的HCN溶液,滴定曲线如图所示,下列说法正确的是( )

A. Ka(HCN)的数量级为10-8
B. 点①时,向溶液中滴入几滴1mol/L的HCN溶液,溶液中c(H+)/ c(HCN)的值增大
C. 点②时,溶液中微粒浓度大小关系:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
D. 在标示的四种情况中,水的电离程度最大的是②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/molB.-109 kJ/molC.+109 kJ/molD.+218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
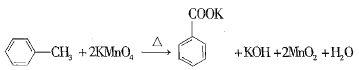
【题目】苯甲酸又称安息香酸,结构简式为![]() ,有关性质如表所示。苯甲酸可用于合成纤维、树脂、涂料等,也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室用高锰酸钾氧化甲苯可制得苯甲酸,相关反应方程式如下:
,有关性质如表所示。苯甲酸可用于合成纤维、树脂、涂料等,也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室用高锰酸钾氧化甲苯可制得苯甲酸,相关反应方程式如下:
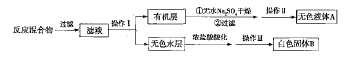
实验时,将一定量的甲苯和高锰酸钾溶液置于图示装置中,在100℃下反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
熔点/℃ | 122.4 |
沸点/℃ | 249 |
密度/( | 1.2659 |
水溶性 | 微溶 |
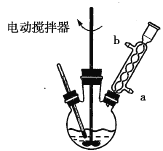
(1)实验中用电动搅拌器进行搅拌的目的是________________。
(2)冷凝管中冷却水是从________(填“a”或“b”)口进入。
(3)操作Ⅰ的名称是,所需的玻璃仪器有________、烧杯;操作Ⅱ的名称是________。
(4)水层用浓盐酸酸化的相关化学方程式为_________________。
(5)如果滤液呈紫色,则要先加入还原剂亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是_______________________。
(6)无色液体A的主要成分是________,白色固体B的主要成分是________。
(7)为测定所得产品的纯度,称取1.220g产品,配成![]() 溶液,取其中
溶液,取其中![]() 溶液进行滴定,消耗
溶液进行滴定,消耗![]() 的物质的量为
的物质的量为![]() ,则产品中苯甲酸的质量分数为________。
,则产品中苯甲酸的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是( )
A.在催化剂存在条件下苯与溴反应制溴苯
B.ClCH2CH=CH2+NaOH![]() HOCH2CH=CH2+NaCl
HOCH2CH=CH2+NaCl
C.乙酸乙酯在碱性条件下水解
D.在一定条件下苯与氢气反应制环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡;
③在50~60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%![]() 溶液洗涤,最后再用蒸馏水洗涤;
溶液洗涤,最后再用蒸馏水洗涤;
⑤将用无水![]() 干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
请回答下列问题:
(1)配制一定比例的浓硫酸与浓硝酸的混合酸时,操作的注意事项是_______________________________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是___________________________________。
(3)步骤④中洗涤粗硝基苯应使用的仪器是___________________________________________________。
(4)步骤④中粗产品用5%![]() 溶液洗涤的目的是___________________________________________。
溶液洗涤的目的是___________________________________________。
(5)纯硝基苯是无色、密度比水_______________________________(填“小”或“大”)的油状液体,它具有________味。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸松油酯是松油醇的酯化产物,具有甜香气味,广泛应用于日用和食用香精中。乙酸松油酯的结构简式如图甲所示,下列说法正确的是
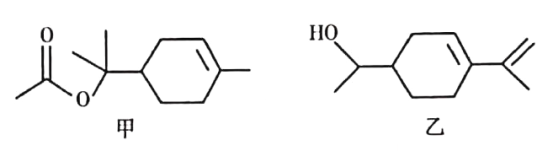
A. 乙酸松油酯的分子式为C12H22O2
B. 乙酸松油酯的水解产物松油醇与图乙所示物质互为同分异构体
C. 乙酸松油酯既易溶于水、也易溶于乙醇或油脂
D. 乙酸松油酯能使Br2的CCl4溶液或酸性KMnO4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com