
【题目】下列有关物质的组成、分类或变化的说法正确的是
A.聚苯乙烯、糖类和蛋白质都是高分子化合物
B.盐酸、高氯酸和氢硫酸都是酸
C.久置于空气中的浓硫酸、NaOH的变质均为物理变化
D.煤的干馏、气化和液化均为化学变化
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是_______________。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.停止实验时,应先停止通入H2,后停止加热
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化;该小组甲同学对反应后的固体产物成分提出如下假设:
假设1:含有Ca和CaH2;
假设2:含有CaH2和CaO;
假设3:含有__________________。
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
实验步骤 | 预期现象和结论 |
取少量固体样品,________ |
(4)定量实验测定Ca和CaH2混合物中CaH2的质量分数。
①取m1 g样品与水完全反应,利用如图装置测定生成的气体体积时,在________时进行收集(填字母)。

a.刚开始有气泡
b.气泡连续均匀
c.气体经过验纯后,再收集
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数________(填“偏高”“偏低”或“无影响”)。
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ.mor1)的实验装罝如图所示。
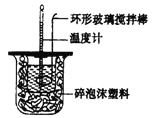
某兴趣小组的实验数值结果小于57.3 kJ/mol,原因可能是________(填字母)。
A.实验装罝保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4 溶液的温度
(2)利用氢气可以制取工业原料乙酸。己知:
A.CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJ/mo1
B.C(s)+O2(g)=CO2(g) △H=-393.5kJ/mo1
C.H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mo1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是___________。
②利用上述信息计算下述反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= kJ/mol 。
(3)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应 A: 4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
![]()
ⅱ.![]()
①写出此条件下反应A的热化学方程式是________________。
断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如图l所示的实验装置(固定装置已略去)。
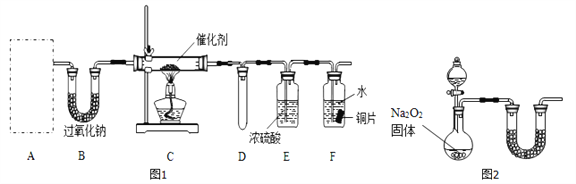
①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_____(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是______________;装置D的作用是____________。
③装置C中发生反应的化学方程式为_________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_______________。
⑤该装置存在的主要缺陷是____________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图2所示装置(其余部分相同)进行实验。
①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是______,U型管中加入试剂是______。
②实验室制备氨气的化学反应方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
Ⅰ.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:
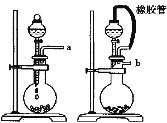
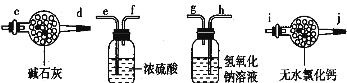
(1)请选择必要地装置,按气流方向连接顺序为 。
(2)分液漏斗中的液体最适合的是 。
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用 。
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO=(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用 (填“酸式”或“碱式”)滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴 指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 1.20 | 16.21 |
2 | 3.00 | 18.90 |
3 | 4.50 | 19.49 |
达滴定终点时的现象为 ,由此可计算出该样品中的氮的质量分数为 。
(5)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值 (填“偏大”“偏小”或“无影响”)。
Ⅲ.如果测定碳酸氢铵中的含氮量时,使用甲醛法是否合理 (填“是”或“否”),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com