
【题目】![]() 通入足量
通入足量![]() 稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入
稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入![]() 溶液,会产生白色沉淀,针对上述一系列变化过程中,下列说法中不正确的是
溶液,会产生白色沉淀,针对上述一系列变化过程中,下列说法中不正确的是
A.上述过程中,最终被还原的是![]()
B.从上述过程中可以得出结论,氧化性:![]() 稀
稀![]()
C.上述过程中,会产生一种无色无味的难溶于水的气体
D.若通入的![]() 完全反应,则同温同压下,
完全反应,则同温同压下,![]() 和逸出气体的体积为3:2
和逸出气体的体积为3:2
【答案】B
【解析】
SO2通入足量![]() 稀溶液中,根据溶液由棕色变为浅绿色,则Fe3+与SO2发生氧化还原化生成SO42-和Fe2+,该过程中发生反应SO2+ 2Fe3++2H2O = SO42-+ 2Fe2+-+ 4H+;立即又变为棕黄色,NO3-(H+)具有强氧化性使Fe2+转化为Fe3+,自身转化为一氧化氮气体,发生反应NO3-+ 3Fe2+-+ 4H+=3Fe3+ NO↑+2H2O,滴入
稀溶液中,根据溶液由棕色变为浅绿色,则Fe3+与SO2发生氧化还原化生成SO42-和Fe2+,该过程中发生反应SO2+ 2Fe3++2H2O = SO42-+ 2Fe2+-+ 4H+;立即又变为棕黄色,NO3-(H+)具有强氧化性使Fe2+转化为Fe3+,自身转化为一氧化氮气体,发生反应NO3-+ 3Fe2+-+ 4H+=3Fe3+ NO↑+2H2O,滴入![]() 溶液,会产生白色沉淀,SO42-证明未参与反应。故最终NO3-被还原。
溶液,会产生白色沉淀,SO42-证明未参与反应。故最终NO3-被还原。
A.由分析可知,最终NO3-被还原,SO2被氧化,A项错误;
B.由分析可知,且根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则氧化性:HNO3>Fe3+>稀H2SO4,B项正确;
C.硝酸根离子在酸性环境下被还原为NO,无色无味的难溶于水,C项错误;
D.最终NO3-被还原,SO2被氧化,根据化合价升价守恒,↑2×n(SO2)=↓3×n(NO),n(SO2):n(NO)=3:2,同温同压下,体积比也为3:2,D项错误;
答案选B。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】将一定量纯净的 A 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s)![]() 2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
A.v 正(B)=2v 逆(C)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中气体 B 的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。
方案I:利用FeO吸收CO2获得H2
i.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)==CO2(g)+2H2(g) △H2=+113.4kJ/mol (1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=__________。
(2)在反应i中,每放出38.0kJ热量,有______gFeO被氧化。
方案II:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2mol CO2和8molH2,发生反应CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。

(3) ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=________。
②300℃时,反应的平衡常数K=________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度_______(填字母)。
A.等于0.8mol/L B.等于1.6mol/L
C.0.8 mol/L <c(CH4)<1.6 mol/L D.大于1.6 mol/L
(4)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g),则v正____v逆(填“>”“<”或“=”)。
(5)已知:200℃时.该反应的平衡常数K=61.8L2·mol-2。则△H4___0(填“>”“<”或“=”)。
方案Ⅲ:用碱溶液吸收CO2
利用100mL3mol/LNaOH溶液吸收4.48LCO2(标准状况),得到吸收液。
(6)该吸收液中离子浓度的大小排序为____________。将该吸收液蒸干,灼烧至恒重,所得固体的成分是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图的说法不正确的是( )

A. 1mol固态碘与![]() 化合生成2molHI气体时,需要吸收5kJ的能量
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与![]() 时需要吸收12kJ的能量
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与![]() 生成HI气体的反应是吸热反应
生成HI气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H22NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成![]() 键、
键、![]() 键、1molN≡N放出能量分别为436kJ、391kJ、946kJ。则:
键、1molN≡N放出能量分别为436kJ、391kJ、946kJ。则:
(1)若完全反应生成2mol![]() 可______
可______![]() 填“吸收”或“放出”
填“吸收”或“放出”![]() 热量______kJ。
热量______kJ。
(2)如果将![]() 和
和![]() 混合,使其充分反应,放出的热最总小于上述数值,其原因是______。
混合,使其充分反应,放出的热最总小于上述数值,其原因是______。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成![]() ,则用
,则用![]() 表示的化学反应速率为______。
表示的化学反应速率为______。
(4)在四个不同容器中,不同条件下进行合成氨反应。根据在相同时内内测定的结果,判断该反应的速率由大到小的顺序是______![]() 用编号填写
用编号填写![]() 。
。
A.v(NH3)=0.5mol/(Lmin) B. v(H2)=0.3mol/(Lmin)
C.v(N2)=0.2mol/(Lmin) D. v(H2)=0.01mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CH4与Cl2的反应(如图所示)叙述不正确的是
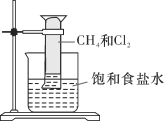
A. 该反应的生成物有四种
B. 该反应属于取代反应
C. 该反应的条件是光照
D. 该反应的现象是量筒内气体颜色变浅,器壁上有油状液滴,量筒内液面上升并产生白雾,溶液中有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列5种基团中的2个不同基团两两组合,形成的有机物能与NaOH溶液反应的有
①-OH②-CH3③-COOH④![]() ⑤-CHO
⑤-CHO
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。请回答:

(1)稀盐酸中加入少量FeCl3溶液的作用是________。
(2)使用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下;________。
(3)实验结束时,待恢复至室温,先________,再平视刻度线读数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com