
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1
H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
(4)在右图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___ 极,该电极反应式是 。
【答案】(1)c(CH3OH)×c(H2O)/[c(CO2)×c3(H2)], +41.2;(2)CD;(3)表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响;
(4)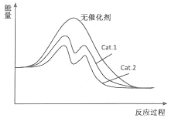 ;(5)阴,CO2+6H++6e-==CH3OH+H2O。
;(5)阴,CO2+6H++6e-==CH3OH+H2O。
【解析】
试题分析:(1)根据化学平衡常数定义,K= c(CH3OH)×c(H2O)/[c(CO2)×c3(H2)],CO的燃烧热:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1 ①,H2燃烧热:H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ·mol-1 ②,H2O(l)=H2O(g) △H=+44.0kJ·mol-1 ③,②+③-①得出:CO2(g)+H2(g)=CO(g)+H2O(g) △H=(44-285.8+283.0)kJ·mol-1=+41.2kJ·mol-1;(2)使用催化剂,对化学平衡无影响,只提高化学反应速率,故选项AB错误;C、CO2→CH3OH,此反应是放热反应,根据勒夏特列原理,降低温度,平衡向正反应方向移动,CO2的转化率提高,故正确;D、投料比不变,增加反应物的浓度,根据勒夏特列原理,提高反应物的浓度,平衡向正反应方向移动,CO2的转化率提高,故正确;E、增大CO2和H2的初始投料比,是提高CO2的量,虽然平衡向正反应方向移动,但CO2的转化率降低,故错误;(3)因为催化剂对化学平衡无影响,因此表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响;(4)催化剂降低活化分子的活化能,根据表格数据,Cat.2的甲醇选择性大于Cat.1,因此图像是: ;(5)CO2中C的化合价为+4价,甲醇中C的化合价为-2价,化合价降低,根据电解原理,甲醇应在阴极上产生,因此电极反应式为:CO2+6H++6e-=CH3OH+H2O。
;(5)CO2中C的化合价为+4价,甲醇中C的化合价为-2价,化合价降低,根据电解原理,甲醇应在阴极上产生,因此电极反应式为:CO2+6H++6e-=CH3OH+H2O。


科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的工业原料,能溶于水,不溶于乙醇,其工业制法如下。请回答:
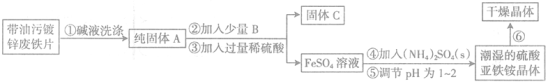
(1)步骤①中碱液洗涤的目的是 。若将碱液换为酸液,可能产生的问题是_ 。
(2)步骤②中B可以是 (填字母),加入少量B的目的是 。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(3)步骤⑥中要用到少量乙醇洗涤,其目的是 。
(4)用硫酸亚铁按晶体配制溶液时,需加入一定量硫酸,目的是 。工业上常用酸性KMnO4溶液通过滴定的方法测定硫酸亚铁铵样品的纯度,反应的离子方程式为 。准确量取硫酸亚铁铵溶液时,硫酸亚铁铵溶液应盛放于 (填“酸式”或“碱式”)滴定管中。
(5)硫酸亚铁铵晶体的样品中可能含有的杂质离子是 ,实验室的检验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年科学家首次利用X射线观测到化学反应过渡态的形成。在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子。 下列关于说法正确的是

A.CO与CO2均为酸性氧化物
B.大量CO2的排放可导致酸雨的形成
C.CO与O形成化学键过程中有电子转移
D.相同条件下,CO的密度比CO2的密度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示0。
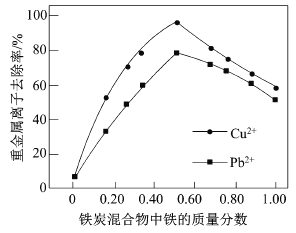
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
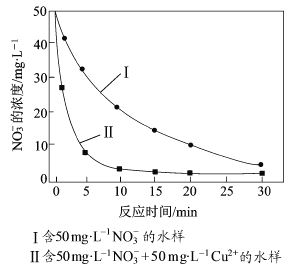
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤。相关物质的溶解度曲线如图所示。下列说法不正确的是
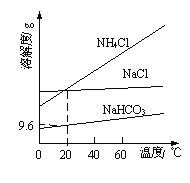
A.将NaHCO3加热分解可得纯碱
B.常温下碳酸氢钠的溶解度大于碳酸钠
C.采用蒸发结晶从溶液中分离出NaHCO3
D.20℃时,NaHCO3饱和溶液的物质的量浓度约为1.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为( )
A.C30H60 B.C30H56 C.C30H52 D.C30H50
查看答案和解析>>
科目:高中化学 来源: 题型:
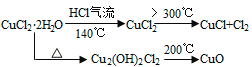
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
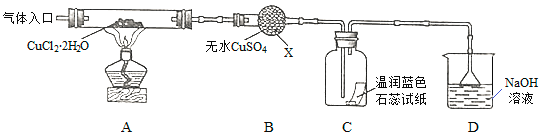
请回答下列问题:
(1)仪器X的名称是__________。
(2)实验操作的先后顺序是a→______→c(填操作的编号)
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_______。
(4)装置D中发生的氧化还原反应的离子方程式是________________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是________________。
②若杂质是CuO,则产生的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某些反应看,NH3和H2O、NH4+和H3O+、NH2—和OH-、N3-和O2-两两类似。据此判断下列反应正确的是
①CaO+2NH4Cl===CaCl2+2NH3↑+H2O②2Na+2NH3===2NaNH2+H2↑
③3Mg(NH2)2===Mg3N2+4NH3↑④NH4Cl+NaNH2===NaCl+2NH3↑
A.只有③
B.只有①
C.①和②
D.都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 二氧化硅可制玻璃、单质硅、光导纤维;
B. 食盐、糖、醋可作调味剂,不可作食品防腐剂;
C. 金属腐蚀的本质是金属原子失电子被氧化的过程;
D. 大量服用阿司匹林会出现水杨酸中毒症,可静脉滴注NaHCO3溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com