
��(N2H4)�ֳ���������һ�ֿ�ȼ��Һ�壬�������������ﷴӦ�������ɵ�����ˮ�����������ȼ�ϣ�
(1)д������һ��������Ӧ�Ļ�ѧ����ʽ________��
(2)�¡�������ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20����30����KOH��Һ���õ�طŵ�ʱ�������ĵ缫��Ӧʽ��________________________��
(3)��ͼ��һ���绯ѧװ��ʾ��ͼ�����¡�������ȼ�ϵ������װ�õĵ�Դ��
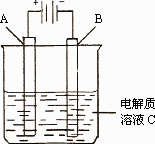
�����AΪ��������������̼�����ʵĴ�ͭ��BΪ��ͭ��CΪCuSO4��ͨ��һ��ʱ�����Һ��Cu2+��Ũ�Ƚ�________(���������С�����䡱)��
�����A�Dz��缫��B��ʯī�缫��C�����ᣬ�����ĵ缫��Ӧʽ��________�����ø�װ�ÿ��Ƶ������������⣺��������![]() ��������
��������![]() (�������������)��
(�������������)��![]() ��H2O��Ӧ����H2O2��
��H2O��Ӧ����H2O2��![]()
![]() ����Ҫ��ȡ1 mol��H2O2����ȼ�ϵ��������������________mol��N2H4��
����Ҫ��ȡ1 mol��H2O2����ȼ�ϵ��������������________mol��N2H4��
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)��(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��101 kPaʱ��32.0 g N2H4����������ȫȼ�����ɵ������ų�����624 kJ(25��ʱ)��N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ��____________________________________________________________________��
(2)��-����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������20%��30%��KOH��Һ��д����-����ȼ�ϵ�طŵ�ʱ���������ĵ缫��Ӧʽ��
������________________________________��
������________________________________
(3)ͼ2-2-5��һ���绯ѧ����ʾ��ͼ��
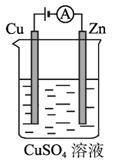
ͼ2-2-5
��пƬ�Ϸ����ĵ缫��Ӧ��________________________________________________��
�ڼ���ʹ����?����ȼ�ϵ����Ϊ�������еĵ�Դ��ͭƬ�������仯128 g������-����ȼ�ϵ�����������ı��״���µĿ���___________L(��������������������Ϊ20%)
(4)��ͳ�Ʊ��µķ���������NaClO����NH3���Ƶ��µ�ϡ��Һ���÷�Ӧ�����ӷ���ʽ��________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����и������Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��
��N2(g) + 2O2(g) =2 NO2(g) ��H = +67��7kJ/mol
��2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ��H = ��1135��7kJ/mol
����˵����ȷ����
A��N2H4(g) + O2(g) = N2(g) + 2H2O(g) ��H = ��1068 kJ/mol
B�������백���Ƶ������������ˮ������뷽��ʽ��N2H4 + H2O = N2H5+ + OH-
C�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ��ŵ�ʱ�ĸ�����Ӧʽ��N2H4 ��4e�� + 4OH�� = N2 + 4H2O
D�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ�����һ��ʱ���KOH��Һ��pH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����и������Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��
��N2(g) + 2O2(g) =2 NO2(g) ��H = +67��7kJ/mol
��2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ��H = ��1135��7kJ/mol
����˵����ȷ����
A��N2H4(g) + O2(g) = N2(g) + 2H2O(g) ��H = ��1068 kJ/mol
B�������백���Ƶ������������ˮ������뷽��ʽ��N2H4 + H2O = N2H5+ + OH-
C�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ��ŵ�ʱ�ĸ�����Ӧʽ��N2H4 ��4e�� + 4OH�� = N2 + 4H2O
D�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ�����һ��ʱ���KOH��Һ��pH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����и������Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��
��N2(g) + 2O2(g) =2 NO2(g) ��H = +67��7kJ/mol
��2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ��H = ��1135��7kJ/mol
����˵����ȷ����
A��N2H4(g) + O2(g) = N2(g) + 2H2O(g) ��H = ��1068 kJ/mol
B�������백���Ƶ������������ˮ������뷽��ʽ��N2H4 + H2O = N2H5+ + OH-
C�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ��ŵ�ʱ�ĸ�����Ӧʽ��N2H4 ��4e�� + 4OH�� = N2 + 4H2O
D�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ�����һ��ʱ���KOH��Һ��pH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����и������Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��
��N2(g) + 2O2(g) =2 NO2(g) ��H = +67��7kJ/mol
��2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ��H = ��1135��7kJ/mol
����˵����ȷ����
A��N2H4(g) + O2(g) = N2(g) + 2H2O(g) ��H = ��1068 kJ/mol
B�������백���Ƶ������������ˮ������뷽��ʽ��N2H4 + H2O = N2H5+ + OH-
C�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ��ŵ�ʱ�ĸ�����Ӧʽ��N2H4 ��4e�� + 4OH�� = N2 + 4H2O
D�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ�����һ��ʱ���KOH��Һ��pH������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com