
【题目】合成H的两条途径如图:


回到下列问题:
(1)关于H说法正确的是_________(填标号)。
a.能使溴水褪色 b.1mol该物质最多能与3mol NaOH反应
c.属于芳香烃类物质 d.分子内最多有9个碳原子共平面
(2)C生成D的反应类型为____________,G的名称为____________。
(3)写出D生成E的化学方程式____________________________________。
(4)已知物质M与D互为同分异构体,M的水溶液呈酸性,在一定条件下2molM能生成1mol分子中含六元环结构的有机物,则M在铜的催化下与氧气反应的化学方程式为____________________________________________________________。
(5)满足下列所有条件的F(结构简式见已知)的同分异构体的数目有________种。
a.能发生银镜反应 b.苯环上有两个取代基
写出上述异构体中能使FeCl3溶液显紫色,核磁共振氢谱有五组峰且面积比为1:2:2:2:1的结构简式________________________。
(6)结合已有知识和信息并参照上述合成路线,以丙醇为起始原料(无机试剂任选),设计制备 的合成路线。_______________
的合成路线。_______________
【答案】 ad 取代反应 1,3-丙二醇 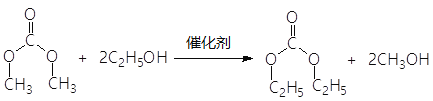
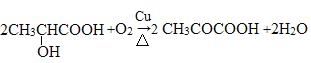 12
12 
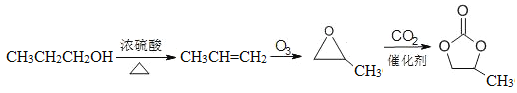
【解析】(1)H分子中有碳碳双键能使溴水褪色,选项a正确。H中的酯基水解得到一个羧基和一个酚羟基,所以消耗2个氢氧化钠,选项b错误。H中有O原子,属于烃的衍生物,不是芳香烃,选项c错误。苯环是平面分子,加上两个双键的平面,所以分子中的9个碳可以都在一个平面上,选项d正确。
(2)根据D的分子式和E的结构简式得到,D应该为 ,所以反应为取代反应。G是在1位和3位各有一个羟基的丙二醇,所以名称为:1,3-丙二醇。
,所以反应为取代反应。G是在1位和3位各有一个羟基的丙二醇,所以名称为:1,3-丙二醇。
(3)D生成E的反应是将D中的两个甲基换成两个乙基,方程式为:

(4)M是D的同分异构体,所以M的分子式也是C3H6O3,分子的不饱和度为1。M的水溶液呈酸性,说明分子中有一个羧基(羧基有一个不饱和度),所以另外的一个氧原子只能是醚键或者是羟基,在一定条件下2molM能生成1mol分子中含六元环结构的有机物,所以只能是羟基,这样进行两分子的酯化得到六元环状酯,为保证得到六元环,羟基一定在羧基的邻位,所以M为![]() ,其催化氧化的方程式为:
,其催化氧化的方程式为: 。
。
(5)F的分子式为C8H8O2,所以分子有5个不饱和度。条件a说明分子有醛基(一个不饱和度),条件b说明分子有苯环(四个不饱和度),且有两个取代基。分子有两个氧原子,如果一个是醛基氧,另一个氧可以是醚键或者羟基,同时还要考虑分子是甲酸酯的可能,所以有: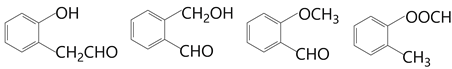 ,一共四种组合,每种组合还有邻间对三种结构,所以一共有12种。能使氯化铁显色说明有酚羟基,只能是
,一共四种组合,每种组合还有邻间对三种结构,所以一共有12种。能使氯化铁显色说明有酚羟基,只能是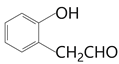 的邻间对,核磁共振氢谱有五组峰且面积比为1:2:2:2:1,说明是
的邻间对,核磁共振氢谱有五组峰且面积比为1:2:2:2:1,说明是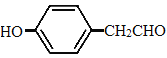 。
。
(6)根据题目A→B→C的反应可知,只要合成出丙烯,重复以上三步反应,就可以得到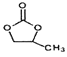 。所以路线为:
。所以路线为: 。
。


科目:高中化学 来源: 题型:
【题目】常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是
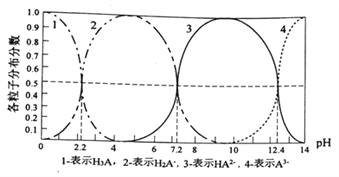
A. NaH2A水溶液呈碱性
B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+![]() c(HA2-)+
c(HA2-)+![]() c(A3-)
c(A3-)
C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,![]()
D. 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
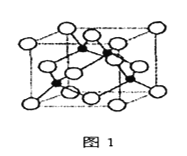
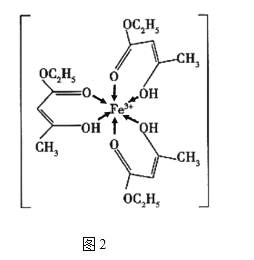
【题目】金属铁、铜及其化合物在科学研究和工业生产中具有重要的用途。下图1表示铜与氯形成化合物A的晶胞(黑球代表铜原子)。图2是Fe3+与乙酰乙酸乙酯形成的配离子B。
回答下列问题
(1)基态Cu原子的核外电子排布式为____________________________。
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)________I1(Cu)(填“>“<”或“=”)
(3)化合物A的化学式为____________,Cl原子的配位数是____________。
(4)B中碳原子的杂化轨道类型为________,含有的化学键为________(填字母)。
a.离子键 b.金属键 c.极性键 d.非极性键
e.配位键 f.氢键 g.σ键 h.π键
(5)化合物A难溶于水,但易溶于氨水,其原因可能是________________;与NH3互为等电子体的分子有________________(写化学式,一种即可)。NH3的键角大于H2O的键角的主要原因是________________________________________。
(6)已知化合物A晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则该晶体中两个Cu原子之间的最短距离为________________________nm(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烷(C8H18)是汽油的重要成分,其与O2反应的能量变化如图所示。下列判断正确的是
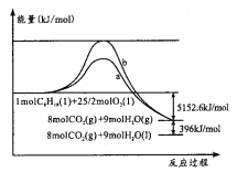
A. 曲线b代表加入催化剂时的能量变化
B. 反应物的总能量小于生成物的总能量
C. 表示辛烷燃烧热的热化学方程式:C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-5152.6kJ/mol
D. 反应a、b的活化能不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0. 6 g H2中含有氢原子数为_________。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为____________。
(3)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c(SO42-)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可分为一次能源和二次能源,自然界中以现成形式提供的能源称为一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。据此判断,下列叙述正确的是
A. 天然气是二次能源 B. 石油是二次能源
C. 电能是一次能源 D. 水流是一次能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是 ( )
A. 某无色溶液中可能大量存在H+、Cl-、MnO、K+
B. 使红色石蕊试纸变蓝的溶液中,H+、Al3+、Cl-、NO3-
C. Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+===2Fe3++2H2O
D. 稀硫酸与Ba(OH)2溶液的反应:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应不属于氧化还原反应的是
A. 2NaOH+H2SO4===Na2SO4+2H2O B. 3CO+Fe2O3![]() 3CO2+2Fe
3CO2+2Fe
C. 2Na+2H2O====2NaOH+H2↑ D. 2Na2O2+2CO2===2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S以及COS(羰基硫)是化学工作者重要的研究对象。请回答下列问题:
(1)COS的分子结构与CO2相似,COS的电子式为_________。
(2)已知:①COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol
②COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3
则ΔH3=__________
(3)已知常温下,Ksp(CuS)=1.0×10-39,Ksp(PbS)=9.0×10-29。向含有浓度均为0.01mol/L的Cu2+、Pb2+废水中缓慢通入H2S,首先生成的沉淀的化学式是_______;当生成两种沉淀时,c(Pb2+)/c(Cu2+)=__________.
(4)某温度T下,在密闭容器中充入5molH2O(g)和5molCOS(g),测得混合气体中H2S体积分数(Φ)与时间(t)的关系如图所示。
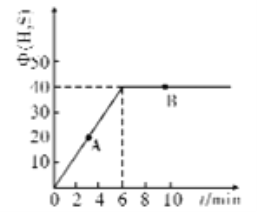
①A点COS的正反应速率_______(填“大于”“小于”或“等于”)B点COS的逆反应速率。
②在该条件下,COS的平衡转化率为________
③在该温度下,该反应的平衡常数K=__________
④在B点对应的体系中,改变下列条件,能使COS转化率增大的是______
A.再通入H2O(g) B.加压 C.降温 D.加入催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com