
����Ŀ������¡�����(2L)���ܱ������г���2 mol SO2��һ������O2��������Ӧ��2SO2(g) + O2(g)![]() 2SO3(g) �� ��H= ��197.74 kJ��mol��1��4min��ﵽƽ�⣬��ʱc(SO2)=0.2mol��L��1����SO2��O2��ת������ȡ�����˵���У�����ȷ����
2SO3(g) �� ��H= ��197.74 kJ��mol��1��4min��ﵽƽ�⣬��ʱc(SO2)=0.2mol��L��1����SO2��O2��ת������ȡ�����˵���У�����ȷ����
A��2minʱ��c(SO2)=0.6mol��L��1
B����O2��ʾ4min�ڵķ�Ӧ����Ϊ0.1mol��(L��min)��1
C�����������г���1mol SO3���ﵽ��ƽ�⣬n(SO2)��n(O2)=2:1
D��4min���������¶ȣ�ƽ�����淽���ƶ���ƽ�ⳣ����С
���𰸡�A
��������
������������������ij�ʼŨ����xmol/L����
2SO2(g) + O2(g)![]() 2SO3(g)
2SO3(g)
��ʼŨ�ȣ�mol/L�� 1 x 0
�仯Ũ�ȣ�mol/L�� 0.8 0.4 0.8
ƽ��Ũ�ȣ�mol/L�� 0.2 x-0.4 0.8
SO2��O2��ת������ȣ���0.4/x=0.8�����x=0.32mol/L
A��0��4min�ڣ���������ķ�Ӧ����=0.8mol/L��4min=0.2mol/��Lmin����ǰ2min��Ӧ���ʴ���0.2mol/��Lmin��������2minʱ��c��SO2����0.6molL-1��A����B����O2��ʾ4 min�ڵķ�Ӧ����Ϊ0.4mol/L��4min=0.1 mol��Lmin��-1��B��ȷ��C�����������г���1 mol SO3�����ɶ�����������������ʵ���֮�Ȳ��䣬�ﵽ��ƽ�⣬���ߵ����ʵ���֮�Ȳ��䣬��n��SO2����n��O2��=2��1��C��ȷ��D����Ӧ�Ƿ��ȵģ�4 min���������¶ȣ�ƽ�����淽���ƶ���K���С��D��ȷ����ѡA��


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����һ���������ォ�л����еĻ�ѧ��ֱ��ת���ɵ��ܵ�װ�á���ͼ��һ������ȼ�ϵ�صĹ���ԭ��ʾ��ͼ�������й�˵������ȷ����

A. B�缫������
B. �����H+��������Ҳ�Ǩ��
C. A�缫�ĵ缫��Ӧʽ�� CH3COOH + 8e-+ 2H2O=2CO2 +8H+
D. �õ�ؿ������л���ˮ���л���������Ϊȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ����С���ͬѧ���ʵ�飬̽��ľ̿��Ũ�����ڼ��������·�Ӧ��������ijɷ֣�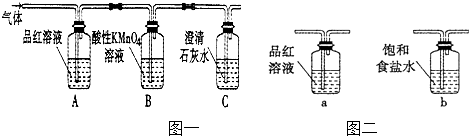
��1����ʵ��̽����
ľ̿��Ũ���ᷴӦ�Ļ�ѧ����ʽ��C+2H2SO4��Ũ���TCO2��+2SO2��+2H2O������ŨH2S04������������������������ԭ������������0.2mol��H2S04��ȫ�μӷ�Ӧ��������̼��������g����̼��Ħ������Ϊ12gmol��1��ͬʱ������CO2������ǣ�����£�L
��2��Aװ����Ʒ����Һ��ɫ�����ɫ������ɫ������֤���������壮
��3��Bװ�õ��������������������Ը��������Һ����SO2���壮
Cװ���еij���ʯ��ˮ����������CO2���壬�����Dz������������ɫ����ɫ������
��4����ʵ�����ۡ�
��ͬѧ��Bװ���ܷ����SO2�����������壬����ΪӦ����B��Cװ��֮��������ͼ��װ�ã���ȷ��SO2�Ƿ������
��5������ϵʵ�ʡ�
ú��ʯ�͵�ȼ�չ����ж��ж�������Ͷ�����̼�ŷţ����ж���������ɵĻ���Ӱ����Ҫ�� �� ������̼��ɵĻ���Ӱ����Ҫ�� �� ��ÿ�ո�ֻ��һ��ѡ�
A������ B���ƻ������� C������ЧӦ
��6��Ŀǰ����չ��̼���á�������̼�����Ϊ����Ĺ�ʶ�������һ�����ֵ�̼��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4�����������Ҫ�ɷ�Ϊ���������������Ͷ������裬��ҵ�Ͼ������й��տ���ұ����������

����˵���д������(����)
A. �٢��г����Լ���������Ҫ���й��˲���
B. a��b����Ԫ�صĻ��ϼ���ͬ
C. ������Ҫͨ������İ���
D. �����еIJ����Ǽ���������dһ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ�Ͳ�Ʒ���ж��ֺ������ʣ���H2S��COS�ȡ�
(1)һ��������Ϊ:���K2CO3-����˹����
��K2CO3��Һ����H2S�ķ�ӦΪK2CO3+H2S=KHS+KHCO3���÷�Ӧ��ƽ�ⳣ���Ķ���ֵΪ1gK=___��
(��֪:H2CO3 lgK1=-6.4, lgK2=-10.3��H2S 1gK1=-7��lgK2=-19)
����֪�����Ȼ�ѧ����ʽ:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ��H1 =-1172kJ��mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ��H2 =-632kJ��mol-1
����˹��������ķ�ӦΪSO2�����H2S���巴Ӧ����S(s)����÷�Ӧ���Ȼ�ѧ����ʽΪ___________________��ͬʱ��COS����ˮ�ⷴӦ: COS(g)+H2O(g)![]() CO2(g)+H2S(g) ��H>0���������������Ӧ������˹��ѡ��Ӧ�¶�Ϊ300�棬�¶ȵ�������____�����¶ȹ��ͻ�ʹ�����������ʹ������ԣ���Ӧ�������Լ�������_______________��
CO2(g)+H2S(g) ��H>0���������������Ӧ������˹��ѡ��Ӧ�¶�Ϊ300�棬�¶ȵ�������____�����¶ȹ��ͻ�ʹ�����������ʹ������ԣ���Ӧ�������Լ�������_______________��
(2)ʯ��ʯ�Ͻ���Ϊ���������Ч���շ����е�SO2����CO2����ͨ��ʯ��ʯ�Ͻ���CaCO3��������л�������������CaCO3�����Ч�ʣ�������Ҫ����Ӧ֮һΪ:2Ca2++2SO2+O2+3H2O = 2CaSO4��![]() H2O+4H+��
H2O+4H+��
�ٷ����������ˮ�����⣬________(�����廯ѧʽ)�����������ࡣ
����������һ�������ϱ�Ϊ1.2ʱ������Ӧ��������Ca2+Ũ�ȵ�Ӱ�졣ͼ��a����Ca(OH)2Ϊ�����ʱ������Ч�ʣ����߱�ʾCaCO3�ʱ�������Ч�ʵ�Ӱ�졣

I.CaCO3��SO2��Ӧ���������Ե���Ca(OH)2��SO2��Ӧ�����ʣ���ԭ����________��
II.a���b������Ч�ʽӽ���ԭ����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ϩ���뱽��һ�������·�Ӧ���ɷ��������磺![]() +H2C�TCH2
+H2C�TCH2 ![]()
![]()
![]() +2H2C�TCH2
+2H2C�TCH2 ![]()
![]()
![]() +2H2C�TCH2
+2H2C�TCH2 ![]()
![]()
��ϩ������ϳɲ��ϵĻ���ԭ�ϣ������ںϳ�Ӧ�ù㷺��DAP��֬�����˫�ӵ��л��������Ҫ�Ĺ�ҵ��;��
��1��д����ϩ��һ�������·����ۺϷ�Ӧ�Ļ�ѧ����ʽ ��
��2����ϩ��������������O2��Ӧ�����л���A���������ܶ�����ͬ״���¼����ܶȵ�6.25����Ԫ�ص���������Ϊ��̼60%����32%��A�ķ���ʽΪ ��
��3����ϩ�뱽��һ�������·�Ӧ������M��N�ȶ��ַ�������������ס��˴Ź������о��л���ṹ����Ҫ�����������������ݣ�д��M��N�Ľṹ��ʽ��
M��Ԫ����ɣ�C 89.99%��H 10.06%��1H�˴Ź�����5���źţ�
N��Ԫ����ɣ�C 88.82%��H 11.18%��1H�˴Ź�����3���źţ�
M�� �� N�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ�Ļ���ԭ�ϣ�2000���������ҹ���ϩ��ʹ�����ѳ�����ϩ������֪�����������ƣ����Ա�ϩΪԭ�Ϻϳɻ���G�߾��C3H4O2��n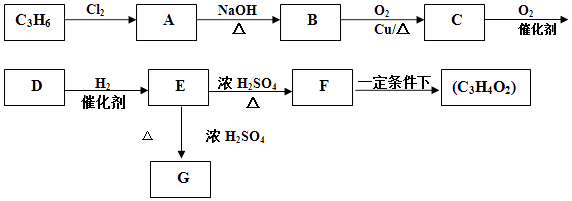
��֪��F�ķ���ʽΪC3H4O2���л���G�ķ���ʽΪC6H8O4 �� ����һ����Ԫ����
��1��E�к��������ŵ������� ��
��2��B��C�ķ�Ӧ��������E��F�ķ�Ӧ������ ��
��3���л���C�Ľṹ��ʽΪ ��
��4����F�ϳɸ߾��C3H4O2��n�Ļ�ѧ����ʽΪ����E�ϳ�G�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ������������������һ��Ϊ����Ԫ�ء�m��n��p��q��r��s������ЩԪ����ɵĶ�Ԫ����Ԫ�����t��Ԫ��Y�ij������ʣ�m ��һ�־���������ɫ�����壬p ����Ư�������������������ʵ�ת����ϵ��ͼ��ʾ������˵���в���ȷ��( )
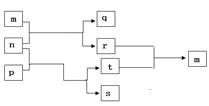
A. ����Ԫ�ؼ����Ӱ뾶��X��Y��Z��W
B. p��s�еĻ�ѧ��������ȫ��ͬ
C. X��Y�ļ��⻯��ķе㣺Y��X
D. �����£�0.01mol/L q��Һ��pHΪ2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ����׳Ʋ��ᣬ�����κͼ���������ˮ������������ˮ�����ᾧ��(H2C2O4��2H2O)��ɫ���۵�Ϊ101����������ˮ��150��-160������������170�����Ϸֽ⡣�ش��������⣺
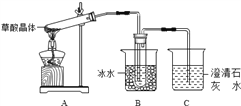
��1������ͬѧ������ͼ��ʾ��װ�ã�ͨ��ʵ�������ᾧ��ķֽ���װ��C�пɹ۲쵽��������__________________________,�ɴ˿�֪���ᾧ��ֽ�IJ�������______________��װ��B����Ҫ������_____________________________________��
��2������ͬѧ��Ϊ���ᾧ��ֽ�IJ����к���H2O��CO��Ϊ������֤��ѡ����ͼ�е�װ�ý���ʵ�顣
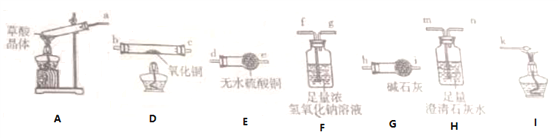
ʵ��װ�����ӵĺ���˳��Ϊa��___________________��k(��Сд��ĸ)����֤�����ᾧ��ֽ��������CO��������______________________________________________________________�����ᾧ�����ȷֽ�Ļ�ѧ����ʽΪ_______________________________________________________________��
��3��������KMnO4��Һ�ζ���Ӧ�������F��Һ,�ⶨNa2C2O4��Ũ��
ʵ�鲽�裺ȡ20.00mLF�е���Һ����ƿ�У�������ƿ�м�������ϡH2SO4,��0.1600mol/L���Ը��������Һ�ζ�,�ζ����յ�ʱ���ĸ�������ܱ�25.00mL��
�����������ҺӦװ��_________(������ʽ��������ʽ��)�ζ����С�
���ζ��յ��������_______________________________________________________��
������F��Һ��Na2C2O4�����ʵ���Ũ��Ϊ_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com