
【题目】石油产品含有多种含硫物质,如H2S、COS等。
(1)一种脱硫工艺为:真空K2CO3-克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为1gK=___。
(已知:H2CO3 lgK1=-6.4, lgK2=-10.3;H2S 1gK1=-7,lgK2=-19)
②已知下列热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1 =-1172kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2 =-632kJ·mol-1
克劳斯法回收硫的反应为SO2气体和H2S气体反应生成S(s),则该反应的热化学方程式为___________________。同时,COS发生水解反应: COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H>0,结合以上两个反应,克劳斯法选择反应温度为300℃,温度低有利于____,但温度过低会使硫析出,降低催化剂活性,反应过慢,以及不利于_______________。
CO2(g)+H2S(g) △H>0,结合以上两个反应,克劳斯法选择反应温度为300℃,温度低有利于____,但温度过低会使硫析出,降低催化剂活性,反应过慢,以及不利于_______________。
(2)石灰石料浆作为脱硫剂可有效吸收废气中的SO2,将CO2气体通入石灰石料浆罐对CaCO3脱硫剂进行活化处理可明显提高CaCO3脱硫的效率,活化后的主要脱硫反应之一为:2Ca2++2SO2+O2+3H2O = 2CaSO4·![]() H2O+4H+。
H2O+4H+。
①废气经脱硫后,除水蒸气外,________(填气体化学式)含量明显增多。
②其他条件一定,物料比为1.2时,脱硫反应的速率受Ca2+浓度的影响。图中a点是Ca(OH)2为脱硫剂时的脱硫效率,曲线表示CaCO3活化时间对脱硫效率的影响。

I.CaCO3与SO2反应的速率明显低于Ca(OH)2与SO2反应的速率,其原因是________。
II.a点和b点脱硫效率接近的原因是________________。
【答案】 3.3 2H2S(g) + SO2(g)=3S(s) + 2H2O(l) △H = - 362 kJ·mol-1 H2S 与 SO2反应平衡正向进行 COS 水解 CO2 相同条件下,Ca(OH)2的溶解度大于CaCO3,溶液中产生的Ca2+浓度比CaCO3 产生的Ca2+浓度大 CaCO3 +CO2 + H2O=Ca2+ +2HCO3-,Ca2+浓度增大
【解析】本题考查化学平衡常数的计算、盖斯定律的应用、外界条件对化学平衡和化学反应速率的影响。
(1)①根据平衡常数的表达式和H2CO3、H2S的电离平衡常数计算。
②应用盖斯定律写出SO2气体和H2S气体反应的热化学方程式。H2S与SO2的反应为放热反应,COS的水解反应为吸热反应,温度低有利于H2S与SO2的反应平衡正向移动,温度过低不利于COS的水解。
(2)①石灰石料浆吸收SO2的原理为2CaCO3+2SO2+O2+H2O=2CaSO4·![]() H2O+2CO2;将CO2通入石灰石料浆活化处理,脱硫的原理为CO2+CaCO3+H2O=Ca(HCO3)2,2Ca(HCO3)2+2SO2+O2=2CaSO4·
H2O+2CO2;将CO2通入石灰石料浆活化处理,脱硫的原理为CO2+CaCO3+H2O=Ca(HCO3)2,2Ca(HCO3)2+2SO2+O2=2CaSO4·![]() H2O+4CO2+H2O;废气脱硫后,CO2含量明显增多。
H2O+4CO2+H2O;废气脱硫后,CO2含量明显增多。
②I.相同条件下,Ca(OH)2的溶解度大于CaCO3,Ca(OH)2溶液中产生Ca2+浓度比CaCO3中产生的Ca2+浓度大,浓度越大反应速率越快。
II.用CaCO3脱硫时会产生CO2,CO2与CaCO3、H2O反应生成可溶性Ca(HCO3)2,溶液中Ca2+浓度增大,使a点和b点的脱硫效率接近。
(1)反应K2CO3+H2S=KHS+KHCO3的离子方程式为:CO32-+H2S=HS-+HCO3-,该反应的平衡常数K=![]() =
=![]() =
=![]() ,lgK=lgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3。
,lgK=lgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3。
②对反应编号,
2H2S(g)+3O2(g)=2SO2(g)+2 H2O(l)ΔH1 =-1172kJ·mol-1(I式)
2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH2 =-632kJ·mol-1(II式)
应用盖斯定律,将(II式![]() 3-I式)
3-I式)![]() 2得,2H2S(g)+SO2(g)=3S(s)+2H2O(l)ΔH=[(-632kJ/mol)
2得,2H2S(g)+SO2(g)=3S(s)+2H2O(l)ΔH=[(-632kJ/mol)![]() 3-(-1172kJ/mol)]
3-(-1172kJ/mol)]![]() 2=-362kJ/mol,H2S气体与SO2气体反应生成S(s)的热化学方程式为2H2S(g)+SO2(g)=3S(s)+2H2O(l)ΔH=-362kJ/mol。H2S与SO2的反应为放热反应,COS的水解反应为吸热反应,降低温度,H2S与SO2的反应平衡正向移动,COS的水解反应逆向移动,温度低有利于H2S与SO2的反应平衡正向移动。温度过低不利于COS的水解。
2=-362kJ/mol,H2S气体与SO2气体反应生成S(s)的热化学方程式为2H2S(g)+SO2(g)=3S(s)+2H2O(l)ΔH=-362kJ/mol。H2S与SO2的反应为放热反应,COS的水解反应为吸热反应,降低温度,H2S与SO2的反应平衡正向移动,COS的水解反应逆向移动,温度低有利于H2S与SO2的反应平衡正向移动。温度过低不利于COS的水解。
(2)①石灰石料浆吸收SO2的原理为2CaCO3+2SO2+O2+H2O=2CaSO4·![]() H2O+2CO2;将CO2通入石灰石料浆活化处理,脱硫的原理为CO2+CaCO3+H2O=Ca(HCO3)2,2Ca(HCO3)2+2SO2+O2=2CaSO4·
H2O+2CO2;将CO2通入石灰石料浆活化处理,脱硫的原理为CO2+CaCO3+H2O=Ca(HCO3)2,2Ca(HCO3)2+2SO2+O2=2CaSO4·![]() H2O+4CO2+H2O;废气脱硫后,除水蒸气外,CO2含量明显增多。
H2O+4CO2+H2O;废气脱硫后,除水蒸气外,CO2含量明显增多。
②I.主要的脱硫反应为2Ca2++2SO2+O2+3H2O=2CaSO4·![]() H2O+4H+;相同条件下,Ca(OH)2的溶解度大于CaCO3,Ca(OH)2溶液中产生Ca2+浓度比CaCO3中产生的Ca2+浓度大,Ca2+浓度越大反应速率越快,所以CaCO3与SO2反应的速率明显低于Ca(OH)2与SO2反应的速率。
H2O+4H+;相同条件下,Ca(OH)2的溶解度大于CaCO3,Ca(OH)2溶液中产生Ca2+浓度比CaCO3中产生的Ca2+浓度大,Ca2+浓度越大反应速率越快,所以CaCO3与SO2反应的速率明显低于Ca(OH)2与SO2反应的速率。
II.用CaCO3脱硫时反应为2CaCO3+2SO2+O2+H2O=2CaSO4·![]() H2O+2CO2,脱硫时会产生CO2,CO2与CaCO3、H2O反应生成可溶性Ca(HCO3)2,反应为CaCO3+CO2+H2O=Ca(HCO3)2,溶液中Ca2+浓度增大,使a点和b点的脱硫效率接近。
H2O+2CO2,脱硫时会产生CO2,CO2与CaCO3、H2O反应生成可溶性Ca(HCO3)2,反应为CaCO3+CO2+H2O=Ca(HCO3)2,溶液中Ca2+浓度增大,使a点和b点的脱硫效率接近。


科目:高中化学 来源: 题型:
【题目】下列各组化合物中,化学键的类型完全相同的是( )
①MgCl2和Na2O②CO2和CS2③Na2S和Na2O2 ④HCl和NaOH
A.①②B.①③C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活和生产中应用广泛。
(1)合成氨用的H2可以CH4为原料制得。有关化学反应的能量变化如下图所示。则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为________________________________________________。

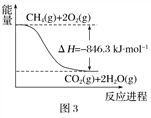
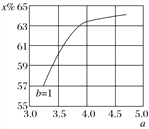
(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在175 ℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式:__________________。
(4)叠氮酸(HN3)是一种一元弱酸,在水溶液中存在:HN3![]() H++N
H++N![]() ,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO![]() 可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮酸是医药合成中的一种重要中间体,某研究小组对苯乙酮酸展开如下设计研究:

已知:I. ![]() II.
II. ![]()
请回答:
(1)下列说法正确的是_____________;
A.反应①②④都是取代反应 B.化合物C能发生消去反应
C.化合物D中含有两种官能团 D.化合物E的分子式为C17H25NO3
(2)反应④D→E的化学方程式是___________________________________。
(3)化合物M的结构简式是___________________________。
(4)写出同时符合下列条件的化合物 的所有同分异构体的结构简式____________。
的所有同分异构体的结构简式____________。
①能发生银镜反应
②1H-NMR谱显示分子中有三种不同化学环境的氢原子。
(5)采用甲苯为原料制备苯乙酮酸(![]() ),请设计该合成路线(用流程图表示,无机试剂任选)_____。
),请设计该合成路线(用流程图表示,无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类对应正确的一组是 ( )
①存在于DNA而不存在于RNA的糖类
②植物细胞主要的储能物质
③人和动物体特有多糖的合成原料
④存在于肝脏细胞而不存在于动物乳汁的糖类
A.核糖、纤维素、乳糖、糖原 B.脱氧核糖、淀粉、糖原、蔗糖
C.脱氧核糖、淀粉、葡萄糖、糖原 D.核糖、淀粉、葡萄糖、糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g) ; △H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是
2SO3(g) ; △H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是
A.2min时,c(SO2)=0.6mol·L-1
B.用O2表示4min内的反应速率为0.1mol·(L·min)-1
C.再向容器中充入1mol SO3,达到新平衡,n(SO2):n(O2)=2:1
D.4min后,若升高温度,平衡向逆方向移动,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮是地球上含量丰富的两种元素。其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
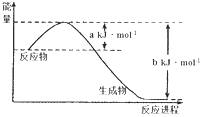
(1)下图是25℃,101kPa时,1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出该反应的热化学方程式____________________________________。
(2)在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:
温度 | n(C)/mol | n(CO2)/mol |
T1 | 0.3 | |
T2 | 0.6 |
请回答下列问题:
①T1℃时,该反应的平衡常数K=___________。
②T2℃时,下列能判断该反应达到平衡状态的是___________(填序号)。
A.v(CO2)正=2v(NO)逆 B.混合气体的平均相对分子质量不再变化
C.混合气体的密度不再变化 D.N2、CO2的物质的量之比不再变化
③T2℃时,若达平衡后再充入0.4molNO和0.3molCO2,平衡向___________(填“正向”“逆向“或“不”)移动。
④若△H<O,则T1___________T2(填“>”或“<”)。
(3)电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示:

①若用NO2气体进行模拟电解法吸收实验,写出NO2发生反应的电极反应式________________。
②若有标况下2.24LNO被吸收,通过阳离子交换膜的H+为___________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com