
【题目】氮及其化合物在生活和生产中应用广泛。
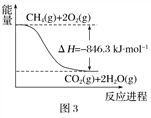
(1)合成氨用的H2可以CH4为原料制得。有关化学反应的能量变化如下图所示。则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为________________________________________________。

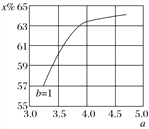
(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在175 ℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式:__________________。
(4)叠氮酸(HN3)是一种一元弱酸,在水溶液中存在:HN3![]() H++N
H++N![]() ,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO![]() 可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
【答案】 CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=161.1 kJ·mol-1  )NaNO3+3NaNH2===NaN3+3NaOH+NH3 ↑
)NaNO3+3NaNH2===NaN3+3NaOH+NH3 ↑ ![]() 2HNO3+2H2O
2HNO3+2H2O![]() 2NH2OH+3O2↑
2NH2OH+3O2↑
【解析】本题以氮及其化合物考查化学反应原理,涉及的考点有盖斯定律、热化学方程式的书写、平衡常数的计算、电极反应式的书写等。(1)图1、图2、图3写出热化学方程式分别为:①CO(g)+![]() O2(g)═CO2(g)△H=-282kJmol-1②H2(g)+
O2(g)═CO2(g)△H=-282kJmol-1②H2(g)+![]() O2(g)═H2O(g)△H=-241.8kJmol-1③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-846.3kJmol-1,由③-(①+②×3)得:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJmol-1,故答案为:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1;(2) 当水碳比由1增大到1.5时,结合方程式2NH3(g)+CO2(g)
O2(g)═H2O(g)△H=-241.8kJmol-1③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-846.3kJmol-1,由③-(①+②×3)得:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJmol-1,故答案为:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1;(2) 当水碳比由1增大到1.5时,结合方程式2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(g),平衡向逆向移动,二氧化碳转化率降低,故其在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图为:
CO(NH2)2(l)+H2O(g),平衡向逆向移动,二氧化碳转化率降低,故其在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图为: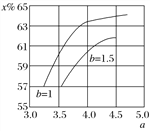 ;(3) 175 ℃时把NaNO3粉末加到熔化的NaNH2中制备NaN3,还生成两种常见的碱性物质为NaOH和NH3,化学反应方程式为:NaNO3+3NaNH2===NaN3+3NaOH+NH3 ↑;(4) 溶液呈中性,c(H+)=10-7,因电离是微弱的,则c(N)=
;(3) 175 ℃时把NaNO3粉末加到熔化的NaNH2中制备NaN3,还生成两种常见的碱性物质为NaOH和NH3,化学反应方程式为:NaNO3+3NaNH2===NaN3+3NaOH+NH3 ↑;(4) 溶液呈中性,c(H+)=10-7,因电离是微弱的,则c(N)=![]() =
=![]() ,c(HN3)= c mol·L-1,Ka=
,c(HN3)= c mol·L-1,Ka=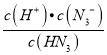 =
=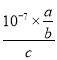 =
=![]() ;(5)由题意可知阴极反应物为NO3—,产物为NH2OH,阳极产物为氧气,故电解反应为2HNO3+2H2O
;(5)由题意可知阴极反应物为NO3—,产物为NH2OH,阳极产物为氧气,故电解反应为2HNO3+2H2O![]() 2NH2OH+3O2↑。
2NH2OH+3O2↑。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中: Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/ c(OH-) = 1×10-12的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe3+) =1 mol·L-1的溶液中: Na+、NH4+、AlO2-、SO42-
D. 能使甲基橙变红的溶液中: K+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氢氧化钠可用食物调整碱性的添加剂
B.棉、麻完全燃烧可以生成CO2和H2O
C.脂肪在一定条件下都能发生水解反应
D.汽油、柴油、煤油的主要成分都是碳氢化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组的同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分.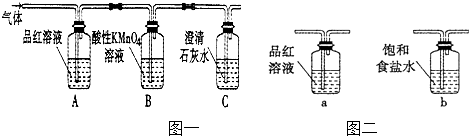
(1)【实验探究】
木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O,其中浓H2S04所起的作用是(填“氧化剂”或“还原剂”).若有0.2mol的H2S04完全参加反应,则消耗碳的质量是g,(碳的摩尔质量为12gmol﹣1)同时产生的CO2的体积是(标况下)L
(2)A装置中品红溶液颜色(填“褪色”或“不褪色”),证明含有气体.
(3)B装置的作用是列用足量的酸性高锰酸钾溶液除尽SO2气体.
C装置中的澄清石灰水是用来检验CO2气体,现象是产生沉淀(填“白色”或“黄色”).
(4)【实验讨论】
有同学对B装置能否除尽SO2气体有有疑义,你认为应该在B、C装置之间连接右图中装置,以确定SO2是否除尽.
(5)【联系实际】
煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是 , 二氧化碳造成的环境影响主要是 . (每空格只填一个选顼)
A.酸雨 B.破坏臭氧层 C.温室效应
(6)目前,发展低碳经济、倡导低碳生活成为国民的共识.请你举一个体现低碳理念的事例 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品含有多种含硫物质,如H2S、COS等。
(1)一种脱硫工艺为:真空K2CO3-克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为1gK=___。
(已知:H2CO3 lgK1=-6.4, lgK2=-10.3;H2S 1gK1=-7,lgK2=-19)
②已知下列热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1 =-1172kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2 =-632kJ·mol-1
克劳斯法回收硫的反应为SO2气体和H2S气体反应生成S(s),则该反应的热化学方程式为___________________。同时,COS发生水解反应: COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H>0,结合以上两个反应,克劳斯法选择反应温度为300℃,温度低有利于____,但温度过低会使硫析出,降低催化剂活性,反应过慢,以及不利于_______________。
CO2(g)+H2S(g) △H>0,结合以上两个反应,克劳斯法选择反应温度为300℃,温度低有利于____,但温度过低会使硫析出,降低催化剂活性,反应过慢,以及不利于_______________。
(2)石灰石料浆作为脱硫剂可有效吸收废气中的SO2,将CO2气体通入石灰石料浆罐对CaCO3脱硫剂进行活化处理可明显提高CaCO3脱硫的效率,活化后的主要脱硫反应之一为:2Ca2++2SO2+O2+3H2O = 2CaSO4·![]() H2O+4H+。
H2O+4H+。
①废气经脱硫后,除水蒸气外,________(填气体化学式)含量明显增多。
②其他条件一定,物料比为1.2时,脱硫反应的速率受Ca2+浓度的影响。图中a点是Ca(OH)2为脱硫剂时的脱硫效率,曲线表示CaCO3活化时间对脱硫效率的影响。

I.CaCO3与SO2反应的速率明显低于Ca(OH)2与SO2反应的速率,其原因是________。
II.a点和b点脱硫效率接近的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原铁粉是化工生产及实验室中常用的还原剂。工业上以绿矾为原料制备还原铁粉的工艺如下:
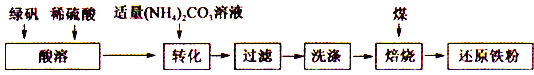
回答下列问题:
(1)酸溶过程中硫酸的作用是________________________ 。
(2)转化的目的是制得FeCO3,加液时应将(NH4)2CO3溶液加入到FeSO4中,原因是_____________。
(3)转化过程中温度不超过35℃,原因是___________________________ 。
(4)生成的FeCO3沉淀需充分洗涤,检验洗涤是否完全的方法是___________________ 。
(5)将FeCO3浊液暴露在空气中,固体表面变为红褐色,同时释放出CO2,写出该反应的化学方程式:________________________ 。
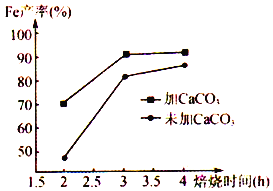
(6)在焙烧过程中需加入CaCO3进行脱硫处理。下图为加CaCO3和不加CaCO3对还原铁粉产率的影响,据图分析CaCO3的另一作用为________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com