
【题目】某校课外活动小组的同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分.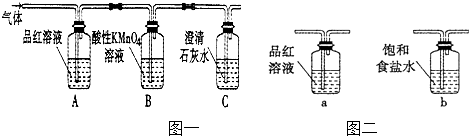
(1)【实验探究】
木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O,其中浓H2S04所起的作用是(填“氧化剂”或“还原剂”).若有0.2mol的H2S04完全参加反应,则消耗碳的质量是g,(碳的摩尔质量为12gmol﹣1)同时产生的CO2的体积是(标况下)L
(2)A装置中品红溶液颜色(填“褪色”或“不褪色”),证明含有气体.
(3)B装置的作用是列用足量的酸性高锰酸钾溶液除尽SO2气体.
C装置中的澄清石灰水是用来检验CO2气体,现象是产生沉淀(填“白色”或“黄色”).
(4)【实验讨论】
有同学对B装置能否除尽SO2气体有有疑义,你认为应该在B、C装置之间连接右图中装置,以确定SO2是否除尽.
(5)【联系实际】
煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是 , 二氧化碳造成的环境影响主要是 . (每空格只填一个选顼)
A.酸雨 B.破坏臭氧层 C.温室效应
(6)目前,发展低碳经济、倡导低碳生活成为国民的共识.请你举一个体现低碳理念的事例 .
【答案】
(1)氧化剂,1.2,2.24
(2)褪色,SO2(或二氧化硫)
(3)白色
(4)a
(5)A,C
(6)采周乘坐公共交通工具、骑自行车或步行等方式出行,少用私家车(或节约用水、用电;改善能源结构,开发新能源(开发无污染的太阳能、风能、地热能)
【解析】解:(1)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O,反应中硫酸分子中S元素的化合价降低,被含有,所以浓H2S04所起的作用为氧化剂;若有0.2mol的H2S04完全参加反应,则消耗碳的物质的量为0.1mol,质量为:12g/mol×0.1mol=1.2g,同时产生的CO2的物质的量为0.11mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L,
所以答案是:氧化剂; 1.2;2.24L;
(2)反应中有二氧化硫生成,则图一的A装置中品红溶液颜色褪色,证明了混合气体中含有SO2,
所以答案是:褪色; SO2(或二氧化硫);
(3)澄清石灰水中通入二氧化碳,二者反应生成白色的碳酸钙沉淀,
所以答案是:白色;
(4)二氧化硫能够使品红溶液褪色,应该在B、C装置之间连接图2中的a﹣品红溶液,用于检验二氧化硫气体是否除尽,
所以答案是:a;
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是酸雨,所以A正确;
二氧化碳造成的环境影响主要是温室效应,所以C正确,
所以答案是:A;C;
(6)体现低碳理念的事例有:①采周乘坐公共交通工具、骑自行车或步行等方式出行,②少用私家车或节约用水、用电,③改善能源结构,开发新能源(开发无污染的太阳能、风能、地热能),
所以答案是:采周乘坐公共交通工具、骑自行车或步行等方式出行,少用私家车(或节约用水、用电;改善能源结构,开发新能源,如:开发无污染的太阳能、风能、地热能).


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为焦炭,则丁可能是O2 B. 若甲为SO2,则丁可能是氨水
C. 若甲为Fe,则丁可能是盐酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的是( )
A | B | C | D | |
实验方案 |
|
|
|
|
实验目的 | 探究温度对平衡的影响 | 比较HCl、H2CO2和 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。现将一块敷有铜箔的绝缘板没入500mL某浓度FeCl3溶液中,一段时间后,将该线路板取出,向所得溶液中加入一定量的铁粉,充分反应后有固体剩余;将固体滤出并从滤液中取出20.00mL,向其中滴入2.00mol/LAgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请回答下列有关问题(忽略反应前后溶液体积的变化):
(1)原FeCl3溶液的物质的量浓度为_____________________。
(2)假若剩余固体中有铁粉,则向溶液中加入的铁粉质量至少应当大于_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活和生产中应用广泛。
(1)合成氨用的H2可以CH4为原料制得。有关化学反应的能量变化如下图所示。则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为________________________________________________。

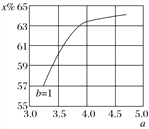
(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在175 ℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式:__________________。
(4)叠氮酸(HN3)是一种一元弱酸,在水溶液中存在:HN3![]() H++N
H++N![]() ,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO![]() 可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2mol CO2,在不同温度下反应CO2 (g)+C(s) ![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中I、II、III点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中I、II、III点均处于曲线上)。下列说法正确的是

A. 反应CO2(g)+c(s)![]() 2CO(g) △H<0
2CO(g) △H<0
B. 体系的总压强P总:P总(状态Ⅱ)![]() 2P总(状态III)
2P总(状态III)
C. 体系中c(CO):6c(CO,状态I)<c(CO,状态II)
D. 从状态I到状态III的升温过程中,每一时刻,正逆反应速率:υ逆>υ正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮酸是医药合成中的一种重要中间体,某研究小组对苯乙酮酸展开如下设计研究:

已知:I. ![]() II.
II. ![]()
请回答:
(1)下列说法正确的是_____________;
A.反应①②④都是取代反应 B.化合物C能发生消去反应
C.化合物D中含有两种官能团 D.化合物E的分子式为C17H25NO3
(2)反应④D→E的化学方程式是___________________________________。
(3)化合物M的结构简式是___________________________。
(4)写出同时符合下列条件的化合物 的所有同分异构体的结构简式____________。
的所有同分异构体的结构简式____________。
①能发生银镜反应
②1H-NMR谱显示分子中有三种不同化学环境的氢原子。
(5)采用甲苯为原料制备苯乙酮酸(![]() ),请设计该合成路线(用流程图表示,无机试剂任选)_____。
),请设计该合成路线(用流程图表示,无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g) ; △H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是
2SO3(g) ; △H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是
A.2min时,c(SO2)=0.6mol·L-1
B.用O2表示4min内的反应速率为0.1mol·(L·min)-1
C.再向容器中充入1mol SO3,达到新平衡,n(SO2):n(O2)=2:1
D.4min后,若升高温度,平衡向逆方向移动,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A (g)+B(g)2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(Lmin),下列说法错误的是( )
A.x=2
B.B的转化率为20%
C.平衡时A的浓度为0.75mol/L
D.恒温达平衡时容器内的压强为开始时的85%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com