
【题目】下列物质中属于天然高分子化合物的是( )
A.维生素C
B.牛油
C.花生油
D.蛋白质
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ下图为H2和Cl2生成HCl过程中的能量变化:

请回答下列有关问题:
(1)H2+Cl2═2HCl是_______(填“吸热”或“放热”)反应,反应物的总能量_______(填“>”,“=”或“<”)生成物的总能量;
(2)当有1molHCl生成时,反应_________(填“吸收”或“放出”)的能量为________KJ。
Ⅱ 一个完整的氧化还原反应方程式可拆写成两个半反应式,一个为氧化反应式,一个为还原反应式。
(1)已知某一反应的半反应式分别为CH4+10OH-—8e-=CO32-+7H2O和O2+2H2O+4e-=4OH-请写出该反应的总反应式:________________________。
(2)下图为氢氧燃料电池的构造示意图:

X极为电池的______________(填“正”或“负”)极,X极的电极反应式为_____________________;若电池工作过程中有5.6LO2(标准状况下)参与反应,则转移电子的物质的量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:

(1)仪器A的名称是_____________;实验前先将仪器按图连接好,然后_____________,再开始实验;
(2)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气,解释放出氨气的原因________________;
(3)本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:_____________,这个反应说明氨气具有______________(填编号);
A.碱性 B.还原性 C.氧化性 D.不稳定性
(4)洗气瓶中浓硫酸的主要作用是________________;
(5)在最后出气管口收集干燥纯净的氮气,收集方法是_________(填编号);
A.排空气法 B.排水法 C.用气囊收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量氨气涉及下列装置,其中正确的是
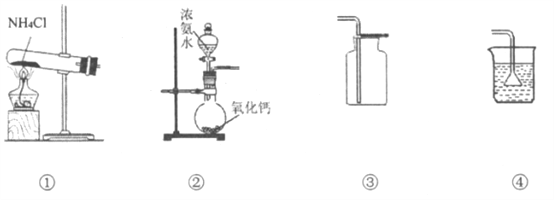
A. ①是氨气发生装置 B. ②是氨气发生装置
C. ③是氨气收集装置 D. ④是多余氨气吸收装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为焦炭,则丁可能是O2 B. 若甲为SO2,则丁可能是氨水
C. 若甲为Fe,则丁可能是盐酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
(1)已知:①H2(g)+1/2O2(g)![]() H2O(l) ΔH1=-285.8 kJ/mol;
H2O(l) ΔH1=-285.8 kJ/mol;
②CO (g)+1/2O2 (g)![]() CO2 (g) ΔH2=-283kJ/mol
CO2 (g) ΔH2=-283kJ/mol
③CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH3=-764.6 kJ/mol
CO2(g)+2H2O(l) ΔH3=-764.6 kJ/mol
则工业制备甲醇的可逆反应热化学方程式为_______________________________;
(2)恒温恒容条件下,下列描述中能说明上述反应已达平衡状态的是__________。
A.单位时间内生成n mol CO的同时生成2n mol H2 B.ν(H2)正=2ν(CH3OH)逆
C.容器内气体的密度保持不变 D.容器中气体的压强保持不变
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,CO物质的量随时间变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
n(CO)/mol | 1.00 | 0.79 | 0.63 | 0.54 | 0.50 | 0.50 |
则从反应开始到20min时,以ν(H2)=________,该温度下平衡常数K=_______。
(4)加入催化剂后在250 ℃开始反应,CO的平衡转化率与温度、压强的关系如图所示。
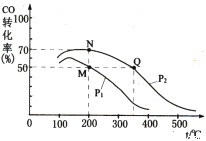
①M、N、Q三点的平衡常数KM、KN、KQ的大小关系为___________________________。
②由M点到N点改变的外界条件是_________。
A、降低温度 B、增大压强
C、改用更好的催化剂 D、通入更多的CO
(5)25℃时以稀硫酸为电解质溶液制成甲醇燃料电池,则负极的电极方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,化学键的类型完全相同的是( )
①MgCl2和Na2O②CO2和CS2③Na2S和Na2O2 ④HCl和NaOH
A.①②B.①③C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
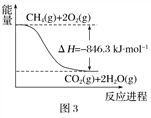
【题目】氮及其化合物在生活和生产中应用广泛。
(1)合成氨用的H2可以CH4为原料制得。有关化学反应的能量变化如下图所示。则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为________________________________________________。

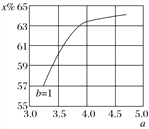
(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______。
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在175 ℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式:__________________。
(4)叠氮酸(HN3)是一种一元弱酸,在水溶液中存在:HN3![]() H++N
H++N![]() ,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________(用含字母的代数式表示,忽略溶液体积变化)。
(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO![]() 可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com